
Giovanni Battista Nazari: Della Traumutatione Metallica Sogni Tre
(A fémátváltozás három álma), 1572
A korszakonként változó illusztrációk és szimbólumok végigkísérik a kémia történetét.1 2 A kívülálló számára a régi jelképek sokszor misztikusak voltak, mintha csak a laikus megtévesztésére szolgáltak volna. Az alkimisták király-, oroszlán-, kígyóábrázolásai mindig megfejtésre szorultak, ahogy a – sokszor versben írt – szövegek is csak a beavatottaknak tárták fel titkaikat.
Nemcsak a reakciók lefolyása, kimenetele volt bizonytalan, hanem a különöző szerzők más-más szimbólumokat is használtak az anyagok megjelölésére. Az alkimista szövegeket ugyanolyan érdekeseknek találhatjuk, mint az idegen nyelven írott lapokat vagy az ismeretlen mitológiák vallásos festményeit. Az alkimista szerzők a bölcsességet kutatták, a közönséges mögött a lényegest keresték, s kortársaik, utódaik többségét felszínesnek ítélték vagy ítélték volna.3
Illusztrációk
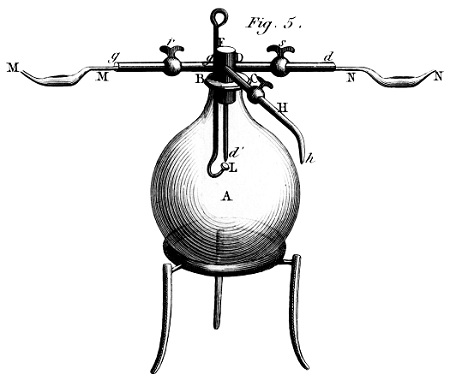
A felvilágosodás fénykorában, 1789-ben, amikor Antoine Lavoisier megjelentette A kémiai alapjait (Traité élémentaire de chimie), az érthetőség a vegyészek fontos célkitűzésévé lépett elő. A kémia kísérleti tudomány, amelyben a műveletek fontos szerepet játszanak; s Lavoisier kitűnő laboratóriumot rendezett be magának. Nagy vetélytársa, Joseph Priestley olyan világosan akart írni, hogy mindenki megismételhesse a kísérleteit.4 Lavoisier berendezéseinek ábráival segítette az olvasókat azoknak a kutatásoknak a követésében, amelyek nyomán megállapította, hogy az oxigén alapvető szerepet játszik az égésben. Képei metszetek voltak, finom satírozásaik jól érzékeltették az edények térbeli alakját, és azt is jelezték, hogyan kell fölszerelni, tartani a készülékeket.5 Az esztétikai konvenció megkövetelte a valósághű ábrázolást: nem tartották elegendőnek, hogy a gömböt kör jelezze.
A XIX. század során a perspektíva érzékeltetése veszített fontosságából, és a készülékekről vonalas, síkbeli ábrák készültek. A régebbi képek még a retortaállványokat és a fogókat is feltüntették. Az elegáns, vonalas rajzok a részleteket már ismertnek tételezték fel, és azoknak szóltak, akik tudtak róluk olvasni. Lavoisier és Davy kívülállóknak szánt, remek prózáját felváltotta a rideg, pontos, tudományos folyóiratokba illő szóhasználat.6 7
Szimbólumok
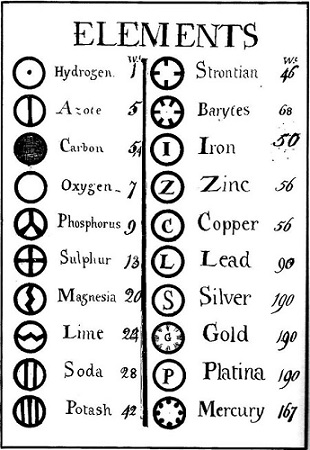
A képletek azonban továbbra is bizonytalanok maradtak: mindenki egyetértett abban, hogy a víz nyolc súlyrész oxigént és egy súlyrész hidrogént tartalmazott, de az összetételt jelző szimbólumokban nem jutottak egyetértésre.8 John Dalton mintás karikái helyett (amelyek az alkimista jelölésekre emlékeztettek) a British Association for the Advancement of Science 1835-ben Berzelius betűi mellett döntött. De még a legegyszerűbb reagensek képleteit is bizonytalanság övezte,9 10 és az atomok létezésében sem voltak biztosak. 1860-ban August Kekulé védnöksége alatt nemzetközi konferenciát hívtak össze Karlsruhéban – ez akkortájt még újdonságnak számított. Jeles tudósok próbáltak egyetértésre jutni a képletek, egyenértékek dolgában. Itt tartotta meg azóta híressé vált előadását Stanislao Cannizzaro. Az 1860-as években a vegyészek többsége elfogadta, hogy az anyag atomos szerkezetű, a víz képlete nem HO, hanem H2O (néha – a matematikusok bosszúságára – H2O-nak is írták), s az oxigén és a nitrogén a levegőben O2 és N2 molekulaként fordul elő.
Az 1870-es években (annak ellenére, hogy a francia kémikusok továbbra is kételkedtek az atomok létében)11 12 a vegyészek jelölni kezdték a molekulákat alkotó atomok „kötéseit”; ha a szerkezetet is jelezni akarták, H–O–H szerepelt a víz képleteként. A szerkezeteket különböző színű golyókból és rudakból is összeállították. J. B. van’t Hoff 1874-ben ismerte fel, hogy a szénatomokhoz tartozó kötések nem egy síkban vannak (mint általában feltételezték), hanem egy szabályos tetraéder csúcsaiba mutatnak. A modelleket, diagramokat áttervezték: amikor a készülékek illusztrációi kétdimenzióssá váltak, a szerkezeteket három dimenzióban kezdték szemléltetni.
Alternatív ábrázolások
A századfordulón már az új konvenciók szerint rajzolták
le a készülékeket, de a feltételezett szerkezeteket többféleképpen
jelölték. A tapasztalati képlet, mint például a H2O,
egyszerűen és tömören jelezte, hogy egy-egy komponens hány
atomja alkotja a molekulát. A szerkezeti képlet, például
a H–O–H vagy esetleg a 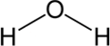 ,
a feltételezett elrendezést is megmutatta, és a bonyolultabb
molekulák háromdimenziós alakját is érzékeltette. Néha,
például a benzol esetében, nem értettek egyet az ábrázolás
módjában. A gyűrűs szerkezetet általában elfogadták, de
abban már nem jutottak egyetértésre, hogy a molekulát váltakozó
kettős és egyszeres kötésekkel, a gyűrű közepe felé mutató
kötésekkel vagy körbe záruló „kolbásszal”
ábrázolják-e.131415
Az utóbbi elgondolás Kekulé ötletet adó álmára, a saját
farkába harapó kígyóra emlékeztetett.16
,
a feltételezett elrendezést is megmutatta, és a bonyolultabb
molekulák háromdimenziós alakját is érzékeltette. Néha,
például a benzol esetében, nem értettek egyet az ábrázolás
módjában. A gyűrűs szerkezetet általában elfogadták, de
abban már nem jutottak egyetértésre, hogy a molekulát váltakozó
kettős és egyszeres kötésekkel, a gyűrű közepe felé mutató
kötésekkel vagy körbe záruló „kolbásszal”
ábrázolják-e.131415
Az utóbbi elgondolás Kekulé ötletet adó álmára, a saját
farkába harapó kígyóra emlékeztetett.16
Közben – a karlsruhei konferencia után elfogadott relatív atomtömegek birtokában – megjelent az elemek első „periódusos rendszere”. A biológusok az élő szervezeteket szemléletesen – például létra, fa vagy körökből álló sorozat formájában17 – próbálták rendszerezni, s a vegyészek is hasonló módszerekkel kísérleteztek.18 J. A. R. Newlands úgy gondolta, hogy megtaláta az „oktávok törvényét”: a hasonló elemek – a hasonló zenei hangok mintájára – minden nyolcadik helyen jelennek meg. Táblázatát ezért hálóba rendezte el. Egyik francia kortársa, Béguyer de Chancourtois, csigavonalban sorakoztatta fel az elemeket úgy, hogy a rokon elemek egymás fölé kerüljenek. Dimitrij Mengyelejev mélyebb összefüggéseket is felfedezett; táblázatában (amelyet eredetileg oktatási célokra szánt) a rokon elemeket vízszintes sorokba rendezte, de a táblázatot hamarosan kilencven fokkal elforgatta; így keletkezett a jól ismert elrendezés.

A minden kémiai előadóteremben kifüggesztett periódusos rendszer és Charles Darwin 1859-ben megjelent híres műve, A fajok eredete nyomán néhány spekulatív elme, például William Crookes és Norman Lokyer arra a gondolatra jutott, hogy az elemek a Napban és a csillagokban keletkeznek – talán egy kozmikus inga lengése nyomán: Crookes háromdimenziós, spirális nyolcasra helyezte el az elemeket.
Az elemek transzmutációjára Ernest Rutherford mutatott példát – ahogyan ő nevezte – az „új alkímia” révén. Rutherford ugyan nem tért vissza a szimbólumok alkímiai gazdagságához, de a Rutherford–Bohr-féle atommodell, amelynek atommagja körül elliptikus pályán keringenek az elektronok, századunk egyik ikonja lett.
G. N. Lewis ezt az atommodellt használta fel vegyérték-elméletében,19 20 amely szerint az atomok elektronok leadásával, felvételével vagy elektronpárok kialakításával kapcsolódnak össze. A szerkezeti képleteken megjelentek az elektromos polaritást jelölő + és – jelek.2122
Linus Pauling „molekula-architekúrái”23 között szabályos sokszögek, „golyó és pálcika” modellek, rugalmas, léggömbszerű – Michelin-figurára emlékeztető – molekulaábrázolások is szerepelnek, s a golyók és pálcikák kontúrjai néha elhalványodnak, mert a XX. századi atomok nem Isaac Newton „szilárd, tömör, kemény és áthatolhatatlan” részecskéi.24 Pauling rezonancia-elméletében az az elgondolás jut szerephez, hogy egy molekula, például a benzol különféle lehetséges szerkezetei jobban megközelítik a valóságot, mint bármely modell önmagában.
Formák és korlátok
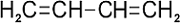
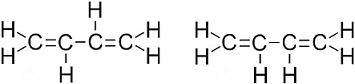
transz (balra), cisz (jobbra)
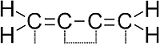
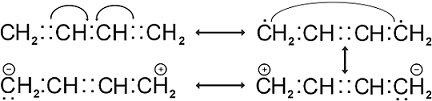
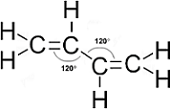
A BUTADIÉN REPREZENTÁCIÓI MARY JO NIE NYOMÁN
Pauling követői ragaszkodnak ahhoz, hogy a szerkezeti kémia nem „csupaszítható le” jobban a fizikára, mint az építészet; minden művészetnek megvannak a korlátai, s az építészeknek a fizika korlátain belül kell maradniuk. Ugyanígy azoknak a vegyészeknek is a természet törvényeit kell követniük, akik a természetben eddig ismeretlen molekulákat állítanak elő. De minden törvény sok szabadsági fokot is megenged, és az ábrázolásban is hasonló szabadságot élvezünk. Mary Jo Nye – az elméleti kémia kialakulását vizsgálva25 – a molekulák számos alternatív ábrázolását mutatja be. Mindegyik változatnak megvan a szerepe és a kontextusa, mindegyik az anyag más-más aspektusára hívja fel a figyelmet.
Az ábrázolás egy másik elegáns módja a betűk elhagyása; a benzol képe tehát egyszerű hatszög, a bonyolultabb molekulák modelljei drótókból hajlított szobrokként jelennek meg. A különleges formák a vegyészeket is izgatják, amint Alex Nickon és Ernest Silversmith játékos nevei példázzák:26 a molekulák a ’lámpán’, ’templán’ (lampane, churchane) nevet kapján a formák hasonlósága alapján.
Ebben a sorozatban Roald Hoffmann ’kempingasztal’ molekulája is szerepel, amelyhez mások készítettek háromlábú székeket. Hoffmann Chemistry imagined27 című érdekes munkájában, melyben egy kiállítás kollázsait reprodukálja, hétféle módon ábrázolja a kámformolekulát, majd felteszi a kérdést:
„Melyik a helyes a hétféle ábrázolás közül? Melyik a molekula? Nos, mindegyik, és egyik sem. Mindegyik modell; bizonyos esetekben alkalmas, máskor alkalmatlan reprezentáció.”

Hoffmann mondatai visszavezetnek bennünket kiindulásunkhoz, a kémiai folyamatokhoz. Az alkímiai illusztrációk néha megmutatták a folyamatokat; a golyókkal és pálcikákkal játszhatunk; a vegyipari létesítmények, például a gázművek28 képei érzékeltetik a kémiai folyamatok dinamikáját is. Van képünk a vulkánokról,29 de a heves kémiai reakciókról alig látunk ábrákat. Ezeket helyettesíthették a leírások, például Davy beszámolója:
„…erős fény mutatkozott a negatív huzalnál, és az érintkezési pontnál … lángoszlop csapott fel. … A gömböcskék gyakran már keletkezésük pillanatában elégtek, néha hirtelen felrobbantak és kisebb gömböcskékké váltak szét, amelyek heves égés közepette nagy sebességgel repültek a levegőben, s gyönyörű tűzcsóvákat húztak.”3031
Ma már nem így írják a tudományos dolgozatokat.
A szuperszámítógépek segítségével a vegyészek túlléphetnek a „golyó és pálcika” modelleken, s a folyamatokat szimulációkkal követhetik nyomon.32 Ezek a képek a laikus számára gyakran tetszetősek, de talán megtévesztőek, ám a magyarázatok ma már nem titkosak, és szorosabban kötődnek a kísérletekhez, mint az alkímia világában. Nyilvánvaló azonban, hogy a vegyész munkájával együtt jár az ábrázolás, a láttatás; a kémikus nemcsak a szavak, hanem a képek nyelvén is beszél.