1. Bevezetés
Kezdő kémiatanárok és gyakorló, tapasztaltabb kollégáik is gyakran szembetalálkoznak azzal a kérdéssel, amelyet gyerekek, szülők, kollégák vagy bárki más feltehet – és fel is tesz – nekik: „Nem lehetne ezt a száraznak és unalmasnak látszó tantárgyat érdekesebbé, életközelibbé tenni?”
A válasz erre a kérdésre: „Lehet.” De nem mindegy, hogyan fog hozzá az ember. A megoldásnak nem abból kell állnia, hogy a gyerekekkel ételfestékek és pillanatragasztók hatóanyagainak képleteit magoltatjuk be, mert ezzel éppen a várt hatás ellenkezőjét váltjuk ki. Más, egyszerűbb, és főleg kivitelezhetőbb jelenségeket kell keresni.
Mi az, amivel a gyerekek nap mint nap találkoznak?
Reménykedjünk, hogy a mai gyerekek – és a következő generációk tagjai is – gyakran vesznek könyvet a kezükbe. A kisebbek még a mesék világában élnek, a nagyobbak inkább szépirodalmat, verseket, esetleg krimiket olvasnak. A kicsik hisznek a varázslatokban, együtt sírnak-nevetnek a szereplőkkel; a nagyobbak már „felnőttesebben” gondolkodnak, de azért még ők is hisznek a csodákban, és néhányukat már érdeklik a fantasztikus dolgok, a misztika.
Érdemes az élet és a mindennapok ezen környékén körbenézni, hátha egy kémiatanár is talál valami érdekeset, számára felhasználhatót. És miért ne találna? Jókai Mór regényei, Móra Ferenc és Agatha Christie történetei, a Biblia sok-sok izgalmas eseményt rejtenek magukban, és ekkor még nem esett szó Aladdin csodalámpájáról, Hófehérke almájáról és a torinói lepel rejtélyéről.
Szakdolgozatom célja az, hogy megpróbáljak minél több érdekességet összegyűjteni a csodák, a misztika és az irodalom világából, amelyek felhasználásával – történetek felolvasása, elmesélése, a hozzájuk kapcsolódó kísérletek elvégzése stb. – színesebbé tehetjük, megkedveltethetjük a kémiaórákat és magát a kémiát.
A dolgozat két fő részre tagolódik. Az első fejezet a misztika, a csodák, a Biblia világába vezeti el az olvasót; a második részben az irodalom, ezen belül a mesék, a szépirodalom és a krimik kémiai vonatkozásairól lesz szó.
1.1. Motiváció [1, 2, 3]
Mi a tanulás? Mi a motiváció és mi a szerepe a tanulási folyamatban?
„A tanulás szó a pedagógiában általában ismeretszerzést, a tudományos világnézet alapjainak elsajátítását, jártasságok és készségek kialakítását, képességfejlesztést jelent, vagy valamilyen speciális tevékenységre utal, amelyet meghatározott céllal, jól körülhatárolt és rendszerint szóbeli anyaggal kapcsolatban, szándékosan végeznek, s amelynek eredményeként a bevésett és megtartott anyag különböző helyzetekben felidézhető.”
Az emberben vannak alapvető, a megismerésre irányuló késztetések. A meglepetés, bizonytalanság, kíváncsiság, mint motivációs tényezők a problémaszituációk tisztázására, megoldására, s ennek érdekében információ-felvételre, tehát tanulásra ösztönöznek.
„Motiváción azoknak a különböző eredetű indítékoknak együttesét értjük, melyek a tanulót a tanulásra ráveszik, és a tanulási kedvet és elhatározást a tanulás végéig ébren tartják. Semmilyen életkorban sincs tanulás motiváció nélkül.”
Motiváló hatást az iskolában a leggyakrabban úgy tudunk elérni, ha valamilyen tevékenységet, eseményt tanulói szerepet vagy tananyagot érdekessé teszünk, azaz felkeltjük tanítványaink érdeklődését. A tapasztalat és több vizsgálat eredménye is arra utal, hogy a tanulási teljesítmények és az érdeklődés között szoros összefüggés van, a megfelelő tanári tevékenység, a motiválás növeli a tanulás hatékonyságát; ám a tanulókban a tanulási motiváció nem elég stabil, viszonylag gyorsan kimerül.
Milyen motivációs lehetőségek állnak a kémiatanár rendelkezésére?
- A kísérletezés olyan kutató-felfedeztető módszer, amely lehetővé teszi különböző jelenségek megfigyelését, érzékelését, majd az összefüggések megragadását, értelmezését. A módszer didaktikai előnye az, hogy a tanulókat a cselekvési oldalról is aktivizálja. (A módszerrel kapcsolatban fontos megjegyezni, hogy sikeressége nagymértékben függ az iskola felszereltségétől és a módszer alkalmazásának gyakoriságától.)
- A csoportmunka gondos előkészítést igényel. A csoportok számára – ezek különböző vagy azonos érdeklődésű tanulókból állhatnak – különböző témájú, nehézségű, követelmény-szintű feladatokat, problémákat adhatunk. Kémiaórákon a csoportmunka összekapcsolódhat a kísérletezéssel.
- Újabban egyre fontosabb szerepet kapnak a játékok: ezek közvetlen részvételre ösztönzik a tanulókat, fejlesztik a kezdeményező képességet, a kockázatvállalást, a kreativitást, tehát a játék komoly dolog. Milyen játékok kerülhetnek elő a kémiaórán? A különböző kémiai totók, keresztrejtvények mellett versenyszituáció lehet az, hogy pl. a szervetlen vegyületek tárgyalása után ki tud több sárga színű vegyületet felsorolni, vagy ki milyen módszerrel írna levelet, úgy, hogy csak a kémiához értő címzett tudja elolvasni.
- Fontos motivációs tényező lehet a más tantárgyakhoz való kötődés vizsgálata, a kapcsolatok megemlítése, beépítése a tananyagba. Szakdolgozatom második része a kémia irodalmi vonatkozásait vizsgálja.
A tanulás sikere szempontjából a tanítás minősége meghatározó jelentőségű; a tanítás szervezeti, személyi és tárgyi tényezői egyaránt kiemelt szerepet játszanak a tanulási folyamat hatásmechanizmusában, a tanulói aktivitás növelésében. Tehát a tantárgyi tanulásra vonatkozó motivációt befolyásoló legfontosabb tényezők: a tananyag jellege és a tanár személye. (Ez utóbbival persze nincs, nem is lehet baj. Hogy miért? Azért, mert a gyakorló és leendő tanárok egyaránt azt gondolják magukról, hogy ők biztosan jól csinálják, ők azok, akik majd megszerettetik a tananyagot a gyerekekkel… És ez persze nincs mindig így.)
Az oktatás során több probléma is felmerül:
- magas osztálylétszám;
- eltérő képességű tanulók;
- egyes tananyagrészek bonyolultsága;
- a szemléltetőeszköz-ellátottság hiánya;
- rossz tanulási módszer;
- a differenciált tanítási módszerek hiánya;
- a nem életszerű tananyag.
Minden problémát természetesen nem lehet megoldani, de már az nagy siker, ha a gyerekek érdeklődését fel tudjuk kelteni a tantárgy iránt. A következő fejezetekben megpróbálok minél több olyan lehetőséget, módszert összegyűjteni – persze a teljesség igénye nélkül –, amelyekkel a tanulók motiválhatók a kémia tanulására.
2. Kémia a misztikában
Mindennapi életünkben a misztika a hozzá kapcsolódó tudományokkal és áltudományokkal együtt ismét egyre nagyobb szerepet kap. A nagy világvallások és a történelmi egyházak mellett egymás után alakulnak kisebb vallási csoportok, természetfölöttinek vélt eseményekkel foglalkozó társulatok; egyre többen vannak azok, akik valamilyen megmagyarázhatatlannak tűnő történés szemtanúi voltak, és hasonló számban vannak azok, akik magyarázatot is tudnak adni. (Azt, hogy ezek a magyarázatok mennyire helytállóak és pontosak, most inkább ne firtassuk.)
Mit mondhatunk a természettudomány és a vallás kapcsolatáról?
A vallásosság eredetéhez akkor kerülhetünk közelebb, ha megvizsgáljuk, mi alakította ki a vallásos gondolkodást az emberré alakulás során: az ember összefüggéseket fedezett fel a környező világban, és a rend keresésének, felismerésének képessége a bolygó urává tette őt.
A vallások az emberiség legősibb és mindmáig leginkább bevált rendszerező és rendteremtő módszerei; az adott kultúra nyelvén, fogalmainak segítségével tárják elénk a lét értelmére, rendjére vonatkozó végső válaszokat. A vallás és a tudomány egyaránt a világ megértésére törekszik, ám azt fontos megvizsgálni, hogyan jött létre a világ törvényeit kutató és értelmező természettudományos gondolkodás, és miként különült el a vallásos felfogástól.
A természettudomány fejlődésének indulásához a természetet megfelelően értékelő világszemlélet is kellett, annak belátására, hogy az anyagi világ tanulmányozásra érdemes, a megismerés nem csak az elvont gondolkodás, hanem a rendszeres megfigyelés eredménye is, a tudósok pedig korlátozás nélkül kutathatnak, és eredményeiket szabadon terjeszthetik. E feltételek természetesnek tűnnek, de a történelmet vizsgálva azt láthatjuk, hogy a megfelelő légkör csak a középkor keresztény Európájában jött létre.
A sokistenhivő vallások felfogása szerint a világ egyes történéseit az istenek, felsőbbrendű lények vezérlik. Szellemi lények döntései által vezérelt világot az ember nem foghat fel, mert nem ismerheti a felsőbbrendű lény gondolkodását, céljait; nem fürkészheti ki az isteni szándékokat, nem kísérletezhet, nem avatkozhat az isteni világrendbe. A tanulmányozhatatlan világ képzete nem férhet össze a természettudomány létével.
A természettudományos gondolkodás a korábbi istenkép fokozatos átalakulása nyomán jelenhetett meg. Az emberek mind kevésbé tartottak isteneiktől és elkezdtek gondolkozni azon, hogy milyenek azok az erők, amelyek ténylegesen kormányozzák a világot. A sokistenhit gyengülése két területen különösen szembetűnően jelentkezett, Görögországban és a zsidó nép földjén.
Az egyistenhívő vallások szerint Isten a világot az általa adott törvényekkel kormányozza. A Biblia szerint az embert Isten a saját képmására teremtette. Ez azt jelenti, hogy észjárásunk hasonlít az ő gondolkodásmódjára, azaz az ember képes lehet felfogni Isten teremtett világának törvényeit, ez pedig felbátorít a törvények keresésére.
A görögök hagyatékát sok összetevő alkotta, ezek nem egyszerre és nem együtt váltak az európai kultúra részévé. A keresztény teológia kezdetben a Platón filozófiáján alapuló elemekre építkezett, az Arisztotelész rendszerén alapuló skolasztika a 12. századtól Aquinói Szent Tamás munkássága révén vált vezető irányzattá. Ám az idők folyamán egyre nyilvánvalóbbá vált, hogy természettudományos kérdések teológiai módszerekkel nem dönthetők el. A teológiai és természettudományos érvelések keveredése a newtoni mechanika megszületése után szűnt meg, ekkor a természettudományos kutatások elváltak az őket értelmező teológiai és filozófiai meggondolásoktól.
Milyen tapasztalatokat szűrhet le ebből egy kémiatanár?
Elsősorban azt, hogy valóban van kapcsolat a természettudományok – így a kémia – és a természetfölötti dolgok, a vallás között. Másodszor pedig azt, hogy az így megvizsgált kapcsolatokat fel lehet használni a kémiatanítás során. Ehhez persze fel kell tételezni azt, hogy a tanulók rendelkeznek a megfelelő előismeretekkel. Mi az az ismeret, ami felhasználható kémiaórákon?
2.1. Eredetmondák
Minden nép történetének vannak kevéssé ismert részei, homályos foltjai. Ám az emberi leleményesség határtalan, furcsa emberek, csodalátók pedig mindig akadtak – gondoljunk csak a honfoglaló magyar törzsek sámánjaira, az őskori emberek rituális táncaira, vagy akár az indián törzsek varázslóira. Ki gondolná, hogy a kémia itt is milyen fontos szereplő?
2.1.1. A görögök és a tűz [5, 6]
„Már-már kipusztulás fenyegette az emberi fajtát, amikor Prométheusz lelopta számukra az égből a tüzet, amely idáig csak az olümposzi istenek tulajdona volt. A tűz segítségével azután az emberek megtanulták a mesterségeket, az anyag megmunkálását és a fémek feldolgozását, téglát égettek, és házat építettek, mindenféle hasznos szerszámot készítettek maguknak, s amint munka közben fokról fokra ügyesedett a kezük, egyre világosabb lett az értelmük is […]”
Az emberiség történetének kezdetén a legfontosabb tényező a létfenntartás volt. Az őskor embere félt a víztől, a tűztől, a vadállatoktól, és csak lassan, a saját kárán tanulta meg, hogyan védhetné meg magát a viszontagságoktól és természet erőitől, és hogyan használhatná fel őket saját céljaira.
A kémiai tudományok kezdete is erre a korra tehető vissza. Hiszen a tűz, mint az egyik legfontosabb és legfélelmetesebb jelenség, gyorsan az emberi élet meghatározó részévé vált. Ám egy idő után nem volt elegendő a tűz őrzése, meg is kellett gyújtani – így a mesterséges tűzgyújtás lett az emberiség első tudatosan előidézett kémiai folyamata!
A tűz megismerésével az ember anyagismerete is fokozatosan növekedett. Különbséget tudott tenni a száraz és a nedves fa égési tulajdonságai között, szerszámait fából, kőből és csontból készítette, a fa égetésekor keletkező kormot és hamut később festékként használta fel. És ez még csak a kezdet volt…
2.2. Csodák a Bibliá-ban [7]
A Bibliát ismerők – és talán a vallásos tanításokban kevésbé jártas emberek is – valószínűleg egyetértenek abban, hogy ebben a világon legismertebb és legtöbb nyelvre lefordított könyvben rengeteg megmagyarázhatatlan és élő ember által nem megvalósítható esemény, csoda történik; elég, ha csak a csodálatos kenyérszaporításra, a vízen járásra vagy a halottak feltámasztására gondolunk.
Talán nem tűnik eretnekségnek, ha néhány természetfölötti jelenségnek megpróbálunk természettudományos magyarázatot adni, vagy legalább megpróbáljuk modellezni a folyamatot.
2.2.1. Az égő csipkebokor [15, 19, 20, 22]
„Mózes pedig apósának, Jetrónak, Mádián papjának a juhait legeltette. Egyszer, amikor behajtotta a nyájat a puszta belsejébe, eljutott Isten hegyéhez, a Hórebhez. Ekkor megjelent neki az Úr angyala, tűz lángjában egy csipkebokor közepéből. Látta ugyanis, hogy a csipkebokor lángol, de nem ég el.
Erre Mózes így szólt: »Odamegyek, megnézem ezt a különös látványt, miért nem ég el a csipkebokor!« Amikor az Úr látta, hogy odamegy megnézni, szólította őt Isten a csipkebokor közepéből, és azt mondta: »Mózes, Mózes!« Ő azt felelte: »Itt vagyok!« Az Úr ekkor így szólt: »Ne közelíts ide! Oldd le lábadról sarudat, mert a hely, amelyen állsz, szent föld!« Azután azt mondta: »Én vagyok atyáid Istene, Ábrahám Istene, Izsák Istene és Jákob Istene.« Mózes erre eltakarta az arcát, mert nem mert Istenre nézni.”
Milyen kapcsolatban lehet ez a bibliai történet a kémiával? Próbáljuk meg szemléltetni az „égő csipkebokrot” egy kísérlettel.
1. KÍSÉRLET
Szükséges anyagok: 50 cm3 98%-os etil-alkohol (lehet metil- vagy izopropil-alkohol is), 50 cm3 víz.
Eszközök: nagyobb méretű vászondarab, csipesz, Bunsen-égő, 250 cm3-es főzőpohár.
Végrehajtás: A főzőpohárban elegyítsük az alkoholt és a vizet, majd a vászondarabot, ami persze zsebkendő is lehet, mártsuk bele az 1:1 térfogatarányú keverékbe. Óvatosan csavarjuk ki a felesleget, majd a csipesszel tartsuk a Bunsen-égő lángjába. A zsebkendő láthatóan lángol, kék lánggal ég, de nem gyullad meg, sőt, meg sem pörkölődik.
Magyarázat: Vegyük példának az etil-alkohol égését:
$$\mathrm{C_{2}H_{5}OH_{(aq)}+3\ O_{2(g)}=2\ {CO}_{2(g)}+3\ H_{2}O_{(g)}\Delta H=-1365\ kJ/mol}$$Vegyünk 100 g 1:1 arányú víz–etil-alkohol elegyet. 50 g etanol elégetésével 1484 kJ hőenergiát nyerünk. Ahhoz, hogy 50 g vizet szobahőmérsékletről – az egészséges életmód jegyében ez legyen 20 °C – felmelegítsünk 100 °C-ra, 16,7 kJ energia szükséges, az elpárologtatáshoz további 112,8 kJ, ez összesen 129,5 kJ. Vagyis az alkohol égésekor keletkező hő többségét a levegő veszi át, csak egy kis része fordítódik a víz felmelegítésére és elpárologtatására. A felszabaduló hőenergia tehát a levegő és a víz felmelegítésére fordítódik, így a vászondarab nem melegszik fel a gyulladási hőmérsékletére, nem gyullad meg.
Vigyázni kell a megfelelő arányra: ha csökkentjük a víz mennyiségét, a zsebkendő megpörkölődik, túl sok víz jelenlétében pedig nem gyullad meg.
(Megjegyzés: az 1:1 térfogatarányú elegyben az etil-alkohol kisebb sűrűsége miatt csak erős közelítéssel beszélhetünk az 1:1 tömegarányról, de a számolás és az elv bemutatása így sokkal egyszerűbb.)
A kísérlet elvégezhető zsebkendő helyett bármilyen leveles ággal – a bibliai idézetnek megfelelően kereshetünk csipkebokrokat is, csak arra kell figyelni, hogy a leveleken maradjon megfelelő mennyiségű víz-alkohol elegy. Viszont a mi bokrunknak van egy nagy hátránya: nem beszél…
Ezek az ismeretek kapcsolhatók a 9. osztályos termokémia témakörhöz, az égéshő bevezetéséhez, tanulmányozásához; és felidézhetők a 10. osztályban, az alkoholok reakcióinak részletes tárgyalásánál.
2.2.2. A keserű víz [6, 21, 23, 26]
„Mózes ezután elindította Izraelt a Vörös-tengertől. Kimentek a Súr-pusztába, és három napig jártak a pusztában anélkül, hogy vízre akadtak volna. Így jutottak el Márába, de Mára vizét sem ihatták, mert keserű volt. Ezért nevezték el azt a helyet Márának (azaz Keserűségnek). Ekkor a nép zúgolódni kezdett Mózes ellen. Azt kérdezték. »Mit igyunk?« Erre ő az Úrhoz kiáltott, és az Úr egy fadarabot mutatott neki. Amikor ő beledobta azt a vízbe, az édessé változott. Az Úr ott adott nekik parancsokat és rendeleteket, és ott tette őket próbára.”
Hogyan változhatott a keserű víz édessé?
Az ókori emberek munkájukat, tetteiket, mindennapi életüket megfigyeléseikre alapozták – gondoljunk csak a nagyobb folyók környékére jellemző elárasztásos növénytermesztésre vagy a gyümölcsök erjesztésére. Ugyanilyen hasznos és valószínűleg sokszor alkalmazott gyakorlati megfigyelés volt az, hogy keserű vagy sós folyadékokat, főként vizet lehet ihatóvá tenni azáltal, hogy korhadt gallyakat, ágakat áztatnak bennük. Kémiai szemmel tekintve a folyamatot, lehetséges, hogy ioncsere vagy adszorpció játszódott le.
- Az adszorpció heterogén folyamat, gáz vagy oldott anyag nagy felületen való megkötődését jelenti. A korhadt faág térfogatához képest nagy felülettel rendelkezik – nagy fajlagos felületű –, ezért adszorbensnek megfelelőnek tűnik. A mindennapi életben is találkozhatunk az adszorpció jelenségével: dohányzó ismerőseink mellett a ruhánk, hajunk is füstszagú lesz; nedves levegőjű helyiségekben a tárgyak nyirkosak lesznek, mert felületükön megkötik a vízpárát; és nem feledkezhetünk el a hűtőszekrénybe tett, le nem fedett ételek „illatáról” sem.
- Ioncsere esetén egyensúly alakul ki egy elektrolit oldat (ebben az oldott anyag ionjai nem csak az oldószer-molekulákkal állnak kölcsönhatásban, hanem egymással is) és egy ioncserélő között. Az ioncserélő térhálós polimer, amelyben kovalens kötéssel rögzített kationok vagy anionok vannak. A másik ion szabadon diffundálhat az ioncserélőben, vagy el is hagyhatja az ioncserélő fázisát, ekkor az oldatból másfajta ion kerülhet a helyére. A folyamat addig tart, amíg az elektroneutralitás figyelembevételével be nem áll a dinamikus egyensúly, tehát az ioncserélő és az oldat ionjainak egy része ki nem cserélődik.
Ha a váz rögzített negatív töltéseket hordoz, kationcserélőkről; ellenkező esetben anioncserélőkről beszélünk. A természetes ioncserélő ásványok zöme kationcserélő. A legfontosabb kationcserélő ásványok a zeolitok. A zeolitok alkáliföldfém-ionokat cserélnek ki alkálifémionokra, s ezért a vízlágyításban alkalmazhatók. Mivel az ioncsere reverzibilis, ezért a kimerült, tehát alkáliföldfém-ion töltetű ásvány konyhasóoldatban való áztatással regenerálható.
A bibliai történetet a szén tulajdonságainak ismertetésekor, a természetes és mesterséges szenek, és az adszorpció megtanításakor, a 11. évfolyamon olvashatjuk fel.
2.2.3. A bor titka [8, 15, 19, 20, 21]
„Harmadnapon menyegző volt a galileai Kánában. Ott volt Jézus anyja, és Jézus is hivatalos volt a menyegzőre tanítványaival együtt. Amikor fogytán volt a bor, Jézus anyja így szólt hozzá: »Nincs boruk!« Jézus azt felelte neki: »Mi közünk ehhez, asszony? Még nem jött el az én órám!« Anyja ekkor azt mondta a szolgáknak: »Tegyétek meg, amit mond!«
A zsidók tisztulására volt ott hat kőedény, egyenként két vagy három mérős. Jézus azt mondta nekik: »Töltsétek meg az edényeket vízzel!« Színig töltötték őket. Ekkor így szólt hozzájuk: »Most merítsetek, és vigyetek belőle a násznagynak!« Azok vittek neki. Amint a násznagy megízlelte a borrá vált vizet, mivel nem tudta, honnan való – de a szolgák, akik a vizet merítették, tudták –, odahívta a vőlegényt, és azt mondta neki: »Minden ember a jó bort adja először, és miután megittasodtak, akkor a kevésbé jót. Te mindeddig tartogattad a jó bort!« Jézus ezzel kezdte meg csodajeleit a galileai Kánában. Kinyilatkoztatta dicsőségét, és tanítványai hittek benne.”
Bizonyára nagyon sokan örülnének annak, ha otthon, saját kezükkel tudnának vízből bort, vagy más alkoholtartalmú italt varázsolni.
Bár bort vízből varázsütésre készíteni nem tudunk, már régóta ismeretes egy egyszerű eljárás arra, hogy milyen módon lehet vörösborból fehérbort készíteni. Nem kell hozzá túl sok minden, csak egy kis vörösbor, aktív szén és szűrőpapír.
2. KÍSÉRLET
Szükséges anyagok: vörösbor, faszén (vagy aktív szén).
Eszközök: főzőpohár, vegyszeres kanál, tölcsér, szűrőpapír, Bunsen-égő, vas háromláb, azbesztes drótháló.
Végrehajtás: Öntsünk egy főzőpohárba vörösbort, melegítsük forrásig. Ha már forr, adjunk hozzá két kanálnyi faszénport, forraljuk tovább 2–3 percig. Hagyjuk kihűlni a bort, majd szűrjük le. A lecsepegő folyadék színtelen, tehát fehérbort kaptunk. (Összehasonlításként egy másik főzőpohárban ugyanannyi ideig forraljunk azonos mennyiségű vörösbort szén nélkül, utána szűrjük meg. A lecsepegő bor vörös.) Hasonló eredményt kapunk, ha nem forraljuk, hanem fél óráig állni hagyjuk az aktív szénnel a bort. Vörösbor helyett használhatunk piros tintával vagy 1,0%-os fukszinoldattal megfestett desztillált vizet is.
Magyarázat: A nagy felületű aktív szén adszorbeálja a vörösborban lévő festékmolekulákat, így a bor elszíntelenedik.
Ezt a bibliai történetet is felolvashatjuk a természetes és mesterséges szenek, ezen belül az adszorpció jelenségének bemutatásánál, a 11. osztályban.

3. KÍSÉRLET
Hogyan lehet modellezni a bor- és sörkészítést?
(Persze, csak látszatra. Megkóstolni szigorúan
tilos!)
Szükséges anyagok: 8 pasztilla szilárd $\mathrm{NaOH}$, desztillált víz, 15–20 cm3 koncentrált $\mathrm{HCl}$-oldat, fenolftalein indikátoroldat, szilárd $\mathrm{NaHCO_{3}}$, barna festékkel kevert detergens (például valamilyen mosó- vagy mosogatószer).
Eszközök: kancsó, borosüveg, vizespohár, söröskorsó
Végrehajtás: Tegyünk tálcára egy kancsót, egy borosüveget, egy vizespoharat és egy söröskorsót. A kancsóba $\mathrm{NaOH}$-oldatot (8 pasztillát oldjunk fel 200 cm3 desztillált vízben), néhány kristályka fenolftaleint a borosüvegbe, 15–20 cm3 koncentrált $\mathrm{HCl}$-oldatot a vizespohárba, a söröskorsóba pedig négy kiskanálnyi keveréket, amelyet 1:1 arányban $\mathrm{NaHCO_{3}}$-ból és barna festékkel kevert detergensből készítettünk. A kancsó tartalmát öntsük át a borosüvegbe, a kapott oldatot töltsük a vizespohárba, majd a söröskorsóba. (A kancsók és üvegek helyett bármilyen főzőpoharat felhasználhatunk.)

Magyarázat: A kancsóból a borosüvegbe töltve a „vizet”, „bort” kapunk, amely, ha átöntjük a vizespohárba, elveszíti vörös színét, ugyanis a bázis semlegesítődik. (Ha elegendő fenolftaleint tettünk az üvegbe, a folyadék tejszerűnek látszik.) A vizespohár tartalmát átöntve a söröskancsóba, a maradék sav reagál a $\mathrm{NaHCO_{3}}$-tal, $\mathrm{CO_{2}}$ fejlődik (buborékol), a detergens pedig habot képez a „sör” tetejére.

Ez a kísérlet nagyon jó példa arra, hogyan lehet a 9. osztályban, a sav-bázis reakciókról szóló témakör bevezetését izgalmassá tenni. A reakció utolsó lépése 10. osztályban, a kolloidika tanításánál – felületaktív, habképző anyagok – is felhasználható.
2.2.4. Illatszerek [6, 20, 22, 24, 25]
„Volt egy József nevű, derék és igaz férfi, a főtanács tagja, aki nem értett egyet a határozatukkal és tetteikkel. Arimateából, a zsidók egyik városából származott, és maga is várta az Isten országát. Elment Pilátushoz, és elkérte Jézus testét. Aztán levette, gyolcsba göngyölte, és egy sziklába vágott sírba helyezte, amelybe még senki nem feküdt. A készület napja volt, és közeledett a szombat. Az asszonyok, akik Galileából jöttek vele, utánamentek, hogy megnézzék a sírt, hogy miképpen helyezték el a testét. Aztán hazatértek, illatszereket és keneteket készítettek, de a szombatot a parancs szerint nyugalomban töltötték. A hét első napján kora hajnalban a sírhoz mentek, magukkal vitték az illatszereket, amelyeket készítettek. A követ a sírtól elhengerítve találták.”
Már az ókor embere is szerette a kellemes illatokat, így az illatszerkészítés fontos, megbecsült mesterséggé vált – erre utal a fennmaradt ősi receptek sokasága. Az illóolajokat a növényekből (ánizs, gyömbér, ricinus, cédrus, ciprus stb.) egyszerű áztatással és főzéssel vonták ki, majd szűréssel eljutottak a tiszta termékhez.
Érdekes megjegyezni, hogy az illatszerkészítés nem volt hagyományos férfifoglalkozás; akkád ékírásos táblák és bibliai szövegek is utalnak arra, hogy nők készítették a különféle vallási és egyéb alkalmakon használt keneteket és kenőcsöket.
Milyen illatszerkomponensek szerepel(het)nek a középiskolai tananyagban?
glicerin (1,2,3-propántriol). Színtelen, szagtalan, édes ízű, viszkózus folyadék; vízzel és alkohollal minden arányban elegyedik. Nagy viszkozitásának az az oka, hogy molekuláik erős hidrogénkötésekkel összekapcsolt asszociátumok alakjában vannak jelen. Higroszkópossága miatt megakadályozza a bőr kiszáradását, így annak berepedezését, ráncosodását; ám a vízmentes glicerin a száraz bőr maradék nedvességtartalmát is megköti, ezért ez kiszárítja a bőrt.

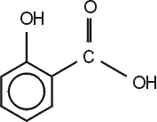
szalicilsav (2-hidroxi-benzoesav). Színtelen, szagtalan, könnyen szublimáló kristályos vegyület. Vízben rosszul, etanolban, éterben jól oldódik. Szabad állapotban előfordul a kamillavirágban és egyes illóolajokban. Felhasználják illatszerek, kozmetikumok előállításához, izzadás gátló hintőporokban adalékanyagként.
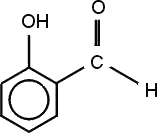
szalicilaldehid (2-hidroxi-benzaldehid). Színtelen, keserűmandula-szagú folyadék, illóolajokban fordul elő.
benzoesav. A legegyszerűbb aromás karbonsav; színtelen, vízben rosszul oldódó kristályos vegyület, észterként és szabad állapotban gyantákban és balzsamokban fordul elő.

eozin. Vörös kristályos por, a fluoreszcein tetrabrómszármazéka, vizes oldata zöldes színben fluoreszkál. Körömlakkok, ajakrúzsok színezésére használják.
aceton (2-propanon). Kellemes szagú, tűzveszélyes, színtelen folyadék, amely vízzel és alkohollal bármilyen arányban elegyedik. Kitűnő oldószer: festékek, lakkok oldására használják. A mindennapi életben körömlakklemosóként alkalmazzák.

mentol. monociklusos monoterpenoid. Fertőtlenítő és görcsoldó hatású, bőrbe dörzsölve helyi érzéstelenítőként hat. A testápoló szerek egyik alkotórésze.
vanillin (4-hidroxi-3-metoxi-benzaldehid). Színtelen, vaníliaszagú kristályos vegyület, amely levegőn oxidálódik.
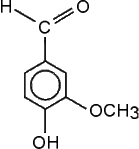
Az illatszerkomponensek felsorolása korántsem teljes. Néhány vegyület (például a glicerin és az aceton) szerves része a 10. osztályos szerves kémiai tananyagnak, többségüket viszont elegendő csak megemlíteni a különböző vegyülettípusok, funkciós csoportok tárgyalásánál. Az érdeklődés felkeltésének még egy lehetséges módja: házi feladatként a következő téma önálló feldolgozása: Milyen ismerős és (még) ismeretlen vegyületek találhatók a fürdőszobában?
2.2.5. A torinói lepel [9, 10, 11]
„Amikor beléptek, nem találták az Úr Jézus testét. Történt pedig, hogy amíg ezen tanakodtak, egyszerre két férfi állt ott mellettük, ragyogó ruhában. Az asszonyok megijedtek, és arccal a földre borultak. Azok pedig így szóltak hozzájuk: »Miért keresitek az élőt a holtak között? Nincs itt, hanem feltámadt. Emlékezzetek csak vissza, mit mondott nektek, mikor még Galileában volt: ’Az Emberfiának a bűnös emberek kezébe kell kerülnie, hogy megfeszítsék, de harmadnapra föltámad.’« Ekkor eszükbe jutottak ezek a szavai. Visszatértek tehát a sírtól, és elmondták mindezt a tizenegynek és a többieknek. Mária Magdolna, Johanna, Mária, Jakab anyja, és a velük lévő többi asszony mondta mindezt az apostoloknak. Ők azonban képzelődésnek tartották szavaikat, és nem hittek nekik. Péter mégis útra kelt, és a sírhoz futott. Behajolt, de csak a lepleket látta, ezért a történteken csodálkozva hazament.”
Jézus születésének kétezredik évfordulóján újra kiállítják a Torinóban őrzött leplet. A várakozások szerint augusztustól októberig több millió zarándok keresi fel azt az ereklyét, amelynek valódiságáról máig heves vitát folytatnak a tudósok.
A torinói lepel a hívők és az ateisták által több alkalommal, aprólékos pontossággal megvizsgált relikvia, amelynek eredetisége – vagy hamissága – körül ma sem csillapodnak a viták. A Bibliából tudjuk, hogy a halott Jézust gyolcsba tekerték, majd zsidó szokás szerint sziklasírba helyezték. Amikor azonban az asszonyok a sírba léptek, hogy bebalzsamozzák a holttestet, a test már nem volt ott, csak a gyolcs maradt a kőpadon.
A lenvászon további sorsa nem ismert pontosan. A 4,36 méter hosszú és 1,1 méter széles, halszálkamintásan szőtt lenvászonnak már az első századokban csodatévő erőt tulajdonítottak, később több helyen is felbukkant, majd 1578-ban került mai helyére, a torinói székesegyház királyi kápolnájába.
A legfontosabb kérdés a lepel kora. Lehetett Jézus Krisztus halotti leple vagy csupán egy értékes középkori lelet? A vásznon látható arckép vérnyom vagy festék műve?
A lepel aprólékos vizsgálata kiderítette, hogy a lepel nem lehet festmény. Miért nem?
A középkorban élő festők szerves fémsókat tartalmazó festékanyagokkal dolgoztak. (A fémsókat, pontosabban a fémionokat röntgensugár-spektroszkópiával lehet kimutatni: az eljárás segítségével a rendszámra, tehát az elem kémiai minőségére következtethetünk.) A lepel vizsgálata során a tudósok arra az eredményre jutottak, hogy ha a vásznon található anyag mégis festék, akkor az olyan anyag, amelyet a 20.századi tudósok egyike sem ismer. A további vizsgálatok, közöttük az IR-spektroszkópia arra engedett következtetni, hogy a vizsgált anyag nem festék, hanem valódi vér. (Az infravörös spektroszkópia a molekulák rezgéseinek gerjesztésével kapcsolatos fényabszorpciót vizsgálja, s ennek segítségével határozza meg a molekula szerkezetét.) Különböző állatoktól származó vérminták összehasonlítása nyomán az is kiderült, hogy a vizsgált anyag emberi vér. Már csak azt kellett eldönteni, hogy milyen régi a lepel. (Ezzel a kérdéssel és a téma középiskolai felhasználásával a 2.3. fejezet foglalkozik.)
2.3. A kumráni tekercsek [12, 13, 14]
Jó néhány évtized telt már el azóta, hogy egy arab pásztorfiú rábukkant a Holt-tenger közelében, Qumranban, egy barlang mélyén az azóta sok vihart kavart és sok vitát kiváltó bőrtekercsekre. Az 1945-ben megtalált, ám csupán két évvel később nyilvánosságra hozott néhány bőrfoszlányt megannyi újabb követte.
A szakértők egybehangzóan kijelentették: a kéziratok nem kevesebb, mint 1500–2000 évesek. A tekercsek szövege pedig – a Habakuk könyvéhez írt kommentár és Ézsaiás próféta könyvének teljes leírása. A keresztény egyház mindkét írást jól ismeri.
Tehát a kutatóknak rengeteg munkájuk akadt. Először került a tudósok kezébe ilyen nagy mennyiségű eredeti ókori kézirat; a tudomány kétezer éves eseményekről kapott információt. Ám a holt-tengeri tekercseket tanulmányozó kutatók csoportja elég gyorsan két részre szakadt. Az egyik csoport szerint a tekercsek Jézus Krisztussal egyidősek, míg a másik tábor azt állította, hogy a holt-tengeri tekercseknek semmi közük Jézus Krisztushoz; a kéziratok azt bizonyítják, hogy a kereszténység az ókori zsidóknak a római elnyomás elleni tiltakozása miatt keletkezett.
A vita középpontjába a kéziratok korának problémája került: a születési dátum meghatározása sok mindent eldönthet.
De hogyan lehet a tekercsek korát megállapítani?
Hosszas vizsgálatok után megállapították, hogy a kumráni kéziratokat a kétezer évvel korábban ott élt zsidó szekta, az esszénusok tagjai írták, és a Jeruzsálemet fenyegető római hadak elől rejtették el a holt-tengeri barlangokba.
Ám a bibliakutatók hadát most újabb kérdés tartja lázban: valóban a holt-tengeri tekercsek egyik elveszett darabja-e az a pergamen, amely nemrég, rejtélyes körülmények között került elő. A Holy Land Egyetem tudósai között egyszer csak szárnyra kapott a hír, hogy a holt-tengeri tekercsek újabb darabját találták meg egy arab kereskedőnél. A kéziratot, amelyen ezer sornyi héber szöveg van, állítólag egy bencés barát vette meg még 1974-ben, és rendházába vitte, ahol a szerzetesek titokban tartották a szerzeményt, és a tekercs tanulmányozásába kezdtek. Ám egyikük megszegte a titoktartást és a lemásolt szöveg eljutott a Holy Land Egyetem neves professzorához: Stephen Pfannhoz.
A tudós szerint a szöveg stílusa I. századi keletkezésre utal. Posztbibliai héber nyelven írták, amelybe görög és arameus kifejezéseket kevertek. A helyesírás és a nyelvtan is emlékeztet az esszénusokéra. Pfann szerint, ha hamisítvánnyal van is dolgunk, az csakis olyasvalakinek a műve lehet, aki alaposan tanulmányozta a holt-tengeri tekercseket, vagyis kitűnő szakértő. Ám ha a pergamen eredeti…
Már néhányszor elhangzott a kérdés: hogyan lehet a holt-tengeri tekercsek, a torinói lepel vagy például egy egyiptomi piramisban talált múmia életkorát eldönteni? A megoldás kulcsa Willard Frank Libby amerikai kémikus kezében volt: az ő nevéhez fűződik a C–14-es izotópos kormeghatározás módszerének kidolgozása. A tudós kutatásait az uránizotópok elválasztásával kezdte, majd a kozmikus sugárzást vizsgálta. Ennek során érdekes eredményre jutott. Ismeretes volt, hogy a Föld légkörét kozmikus sugarak, nagy energiájú atomi részecskék: elektronok, neutronok és atommagok bombázzák. Ezek nagy része az atmoszférát alkotó gázok atomjaival való ütközések során elnyelődik. Mi történik az elnyelő légköri gáz atomjaival? Az egyik, számunkra most kiemelten fontos reakció a nitrogénatomok neutronelnyelése, amelynek során létrejön a szén 14-es számú izotópja:
$$\mathrm{{^{14}_{7}N}+{_{0}^{1}n}={^{14}_{6}C}+{_{1}^{1}H}}$$A C–14 izotóp, mivel nem stabilis, átalakul $\mathrm{^{14}CO_{2}}$-dá, a növények ezt – a levegő $\mathrm{^{12}CO_{2}}$-jával együtt – felveszik, és így bekerül minden élő szervezetbe. A C–14 azonban radioaktív, bomlásakor ß-részecskét sugároz, s nitrogénné alakul át. A bomlás felezési ideje 5570 év. Mi köze ennek a kormeghatározáshoz? Az atmoszférában a $\mathrm{{^{14}C}:{^{12}C}}$ arány közel állandó (körülbelül 1/1012) – a kozmikus sugárzás részecskéi miatt bekövetkező kémiai reakciókban a C–14 izotóp folyamatosan „újratermelődik”, az élővilágban viszont, ha egy élőlény elpusztul, a C–14-es izotóp beépítse abbamarad, a szervezetben lévő mennyiség pedig fokozatosan csökken, a $\mathrm{^{14}C}$ a felezési idejének megfelelően elbomlik, a megmaradó mennyiségből pedig következtetni lehet a halál időpontjára. Az izotóp felezési ideje azonban határt szab a kormeghatározásnak: 300 és 20 000 év között szolgáltat megbízható eredményeket, egy évszázadnyi hibával.
Mégis fel kell tennünk a kérdést: mennyire pontos ez az óra? Már Libby is tudta, hogy módszerének vannak pontatlan elemei. Hogyan lehet mégis pontosítani a kormeghatározást?
Különböző régészeti leletek vizsgálata alapján megállapították, hogy az eljárás „megfiatalítja” a 2000 évesnél idősebb tárgyakat. Mi lehet ennek az oka? A következtetések szerint 20 000 évvel ezelőtt a légkör C–14-tartalma sokkal, akár 40 százalékkal is nagyobb volt, mint manapság; a Föld mágneses terének az erőssége pedig körülbelül a mainak a fele volt.
A földi mágneses tér befolyásolja a C–14 termelődését. A mágneses mező megváltoztatja a Föld felé tartó töltött kozmikus részecskék pályáját; úgy viselkedik, mint egy védőernyő. Minél erősebb ez a mező, annál kevesebb kozmikus részecske jut be a Föld légkörébe; ám ha gyengébb a mágneses mező – mint 20 000 évvel ezelőtt –, több olyan részecske kerül be a felső légrétegbe, amely hozzájárul a C–14 képződéséhez. (Persze más tényezők is módosították a C–14 koncentrációt: a légkörben lévő széndioxid mennyisége és a légkörbe lépő kozmikus részecskék száma is változott az idők folyamán.)
Ezek az eredmények lehetővé teszik, hogy az 50 000 évnél fiatalabb régészeti maradványok korát pontosan meghatározzák – a C–14-es eljárással ennél idősebb leletek kora nem határozható meg, mert bennük az izotópok aránya olyan kicsi, hogy a mérések nem értékelhetők ki.
A holt-tengeri kéziratok korát is Libby módszerével állapították meg: a tekercsek borítójából kivont szén radioaktivitásának meghatározása szerint a kéziratok száz vagy kétszáz évvel időszámításunk előtt, tehát Krisztus születését megelőzően készültek.
Valóban Jézus halotti leple vagy „csak” egy nagyon értékes középkori lelet?
1988-ban három különböző helyen – Zürichben, Oxfordban és Arizonában – a C–14 izotópos eljárással próbálták meghatározni a lepel korát. Kevesebb, mint 50 mg mintából, egymástól függetlenül mindhárom csoport ugyanarra a következtetésre jutott: a vászon 1260 és 1390 között készült, tehát nem lehetett Jézus Krisztus halotti leple. Az eredetiséget vallók viszont azt állítják, hogy az anyag a feltámadáskor olyan hő-, fény- és egyéb hatásoknak lett kitéve, amelyek befolyásolhatják az izotópos vizsgálat eredményét. Egyes szakértők véleménye az, hogy a radiokarbonos eljárás akkor szolgáltat hiteles eredményt, ha a vizsgálat tárgyát nem mozdították el eredeti helyéről. Ez azonban a lepelről aligha mondható el. Amit viszont biztosan állíthatunk: a torinói lepel csodája megfejthetetlen marad.
A torinói lepel és a kumráni tekercsek érdekes és titokzatos történetét nem csak a gyerekeknek, hanem történelem és fizika szakos kollégáinknak is ajánlhatjuk. A C–14-es vizsgálati módszerről beszélhetünk a 9. osztályban, az izotópok tárgyalásánál; de 11. osztályban, a szén és elemeinek megismerésénél újra, talán kicsit részletesebben is előkerülhet.
2.4. A nápolyi csoda [16, 17, 18, 26]
A keresztények egyik kedvelt zarándokhelye Nápoly. Talán sokan nem tudják, hogy a turistalátványosságok mellett van még valami, ami különlegessé teszi ezt az olasz várost: a hely védőszentjének, San Gennaronak ereklyéje, a szent évente többször folyékonnyá váló és újra megalvadó vére.
Az előzményeket érdemes röviden felidézni. A korai keresztényüldözések idejében – az időszámítás utáni negyedik század elején – Gennaro (vagy latin nevén Januarius) püspököt több paptársával együtt lefejezték. Néhány évtized múlva ereklyéit Nápolyba vitték, és a szentté avatott vértanút a város védőszentjének választották. Az 1400-as évektől a többi ereklyén kívül a vértanú vérét tartalmazó két kis üvegcse is megjelent a szertartásokon. Az üvegcséket zárt ereklyetartóban tárolják, trezorban őrzik. Évente csupán három alkalommal, körmenetben viszik körbe a városon, és ekkor rituális mozdulatok és rázás közben a vér folyékonnyá válik, majd ismét megalvad.
Számos tudós foglalkozott a „nápolyi csodával”, többen próbálták reprodukálni a jelenséget. Egy lehetséges megoldás a következő kísérlet.
Az ereklye „titka” a kolloidikából ismert tixotrópia jelensége.
Mi a tixotrópia?
Számos liofil szolnál tapasztalható, hogy a szol állandó hőmérsékleten nyugodt állás közben elveszti folyékony jellegét, géllé alakul át, de a gél mechanikai hatással, rázással, keveréssel újból szollá alakítható vissza. Ez a jelenség a tixotrópia. Tixotrópiát főképp olyan liofil szoloknál tapasztalunk, amelyeknek részecskéi anizodimenziósak, pálcika- vagy lemezalakúak, de nem túl hajlékony fibrillák. A folyamat lényege tehát a részecskék nagy liofilitása és a közöttük lévő adhézió. Éppen ezért a tixotróp megszilárdulás idejét adalékanyagokkal, például elektrolitokkal is befolyásolhatjuk.
4. KÍSÉRLET
Szükséges anyagok: kristályvíztartalmú vas-klorid, szilárd ammónium-karbonát, szilárd kálium-klorid, desztillált víz.
Eszközök: 400 cm3-es főzőpohár, dializáló készülék, 100 cm3-es főzőpohár, mágneses keverő.

Végrehajtás: Egy 400 cm3-es főzőpohárban 100 cm3 desztillált vízben oldjunk fel 116,5 g porrá tört $\mathrm{FeCl3 6H_{2}O}$-t. Addig adjunk hozzá szilárd ammónium-karbonátot, amíg az elegyítés helyén keletkező csapadék összekeveréskor már fel nem oldódik. Ez körülbelül ekvivalens mennyiségű, 62 g $\mathrm{(NH4)2 CO_{3}}$-ot jelent. A keletkező szolt azonnal dialízisnek vetjük alá. A dialízis feladata: a szolban lévő, annak stabilitását és sajátságait megváltoztató elektrolit eltávolítása. Ha egy oldatot a tiszta oldószertől féligáteresztő hártyával elválasztunk, akkor az oldat ionjai vagy molekulái átdiffundálnak a hártyán, s egy bizonyos idő múlva a hártya mindkét oldalán azonos lesz az ion-, illetve a molekulakoncentráció. Ha elektrolitot tartalmazó szolt dializálunk, s a hártya pórusméretét úgy választjuk meg, hogy a szolrészecskék ne tudjanak átdiffundálni rajta, akkor az oldószer folytonos cserélésével a szol elektrolit tartalma tetszés szerint csökkenthető.

A dializátorok a Graham által először használt berendezés elvén alapulnak: fő részük egy, a dializálandó anyagot tartalmazó tartály, amelyet az oldószertől szemipermeábilis hártya választ el.
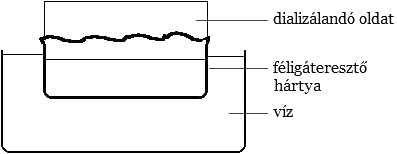
(A vas-hidroxid szol dialízise egy héten keresztül zajlik, az oldószer szerepét betöltő desztillált vizet kezdetben naponta, majd kétnaponta cseréljük.) A dialízis befejezése után a vas-hidroxid szolhoz folyamatos keverés mellett – mágneses keverő – kis részletekben szilárd kálium-kloridot adunk, amíg meg nem indul a szol-gél átalakulás. Az elektrolit hozzáadása után néhány percig még kevertessük az elegyet, majd hagyjuk állni. Figyelni kell arra, hogy tényleg kis részletekben adjuk az elektrolitot a szolhoz, mert az átalakulás hirtelenszerű. Ha a keverék nem elég vérszerű, akkor egy kis KSCN hozzáadásával színezhetjük vörösre elegyünket.
Magyarázat: Az előzőekben már ismertetett tixotrópia jelensége.
A nápolyi csoda, a megalvadó és újra folyóssá váló vér rejtélye 9. osztályban, az oldatokról szóló anyagrésznél mutatható be – de inkább csak kiegészítő anyagként, érdekességként. 11. osztályban, a kolloid rendszerek tárgyalásánál akár modellezni is lehet a jelenséget –, ha adottak a feltételek és az eszközök, és a tanárnak van elegendő türelme a „vér” előállításához.


A zsidó és a korai keresztény tanításokban az egyik legfontosabb probléma a bűnök megbánása, megbocsátása volt – ez egyébként napjainkban is egy igen fontos vallási kérdés. Ezen elv szemléltetésére, bemutatására egy kanadai kutató tervezett egy nagyon érdekes kísérletet: egy vörös színű oldatot – ez a vér – beleöntjük a bűnöket szimbolizáló sötét, szinte fekete keverékbe, amely azonnal színtelenné válik – a vér megtisztítja a bűnöst, eltörli a bűnt. (A kísérletet a redoxifolyamatok tanulmányozásánál, a 9. osztályban mutathatjuk be.)
5. KÍSÉRLET
Szükséges anyagok: szilárd kálium-permanganát, szilárd mangán-szulfát, 2 mol/dm3 koncentrációjú kénsavoldat, 3%-os $\mathrm{H_{2}O_{2}}$ oldat, 1 mol/dm3 koncentrációjú $\mathrm{NaOH}$ oldat, fenolftalein indikátor, desztillált víz.
Eszközök: 250 cm3-es főzőpohár, 150 cm3-es főzőpohár, mérőhenger.
Végrehajtás: Egy 250 cm3-es főzőpohárba mérjünk be 0,05 g $\mathrm{KMnO_{4}}$-t és kb. 0,04 g $\mathrm{MnSO_{4}}$-t, majd adjunk hozzá 25 cm3 2 mol/dm3 koncentrációjú kénsavoldatot és 50 cm3 desztillált vizet. Összekeverés után egy barnás-fekete keveréket kapunk: ez a bűn iszapja.
Egy 150 cm3-es főzőpohárba öntsünk 5 cm3 3%-os $\mathrm{H_{2}O_{2}}$ oldatot, 10 cm3 1 mol/dm3 $\mathrm{NaOH}$ oldatot, 50 cm3 desztillált vizet és néhány csepp fenolftaleint. Az oldat sötétrózsaszín lesz, szinte olyan, mint a vér.
Ezt az oldatot öntsük hozzá a „bűnök”-höz, és figyeljük a „vér” megtisztító hatását. A keverék azonnal színtelenné válik.
Magyarázat: Vizsgáljuk meg először a „bűn” iszapját. A permanganát-ionok jelenléte miatt azt várnánk, hogy a keverék lila színű lesz, ám a kapott anyag barnásvörös színű. Miért? Okozhatja ezt a kálium-permanganátban lévő, szinte elhanyagolható mennyiségű szennyeződés, a barnakőpor is; ám a barna színt okozó mangán-dioxid legnagyobb része a permanganát- és a mangánionok reakciójából keletkezik.
A „vér” piros – inkább rózsaszín – színét a fenolftalein indikátor és a feleslegben lévő $\mathrm{NaOH}$ adja. Az oldatok összeöntésekor a permanganát-ionok redukálódnak, a hidrogén-peroxid oxidálódik, miközben oxigén gáz keletkezik. A kapott oldat színtelen, az el nem reagált hidrogén-peroxid és az alkalmazott koncentrációk miatt.
$$\mathrm{MnO_{2} \text{ (sz)} + 2H_{2}O_{2}\ \rightarrow\ 2\ H_{2}O+O_{2}}$$ $$\mathrm{2KMnO_{4}+3\ H_{2}SO_{4}+5\ H_{2}O_{2}=K_{2}SO_{4}+2\ MnSO_{4}+8\ H_{2}O+5\ O_{2}}$$„A törvény szerint ugyanis majdnem minden dolog vérrel tisztul meg, vérontás nélkül nincs bűnbocsánat.” [7] Zsid 9,22
3. Kémia az irodalomban
Olvasási szokások
A tapasztalat és a statisztikai adatok egyaránt azt mutatják, hogy napjaink elgépiesedő, képernyő-centrikus világában (legyen ez televízió képernyő vagy számítógép-monitor) egyre kisebb szerep jut az újságoknak, a folyóiratoknak és a könyveknek. A tizenéves gyerekek életére egyre nagyobb hatást gyakorol a mozgókép, amelyet átlagosan naponta 180 percig néznek. A nyolcadik osztályosok harminc százaléka súlyos szövegértési problémákkal küszködik. 1990 és 1995 között a 9 és 18 év közötti korosztályok olvasásértési teljesítménye húsz százalékkal romlott. Kutatási adatok szerint az olvasási kedv és a tanulmányi eredmény a napi egy-másfél órát tévézők körében a legjobb, míg a semmit, illetve napi négy óránál hosszabban tévét nézők a gyengébben olvasók és tanulók kategóriájába tartoznak.
A megjelenő gyermekkönyvek példányszáma az elmúlt két évtizedben a negyedére apadt, miközben a 6–14 éves korosztályok létszáma csupán 18 százalékkal csökkent. A „felnőtt-könyvek” összpéldányszáma kisebb mértékben apadt; ez azt jelenti, hogy a felnőttek olvasási kedve kevésbé csökkent, mint a gyerekeké. (Persze, ha korosztályonként vesszük szemügyre a felnőtt társadalmat, az derül ki, hogy inkább az idősebb korosztályok olvasnak, akik évtizedekkel ezelőtt még az olvasásra szocializálódtak.)
A szülő vonzó vagy taszító példája, az otthoni könyvek száma, a meghitt felnőtt-gyerek kapcsolat ereje nem becsülhet le. A szülők, nagyszülők mellett a szeretett óvónők, tanítók, tanárok is gyakran válnak az utánzásra, a mintakövetésre ösztönző modellszemélyiséggé. A gyerek olvasóvá válásához „elegendő” jó családba születni, jó óvodát és iskolát választani, lehetőleg olyan településen, ahol van egy-egy jól megközelíthető könyvtár, könyvesbolt, és az iskolai tantestület egésze ebbe az irányba tereli a tanulók figyelmét, megértvén, hogy a történelmet, a fizikát, a földrajzot, de még a matematikát és a kémiát is könnyebben érti, tanulja a gazdag szókinccsel rendelkező, olvasni szerető és tudó, kíváncsi, kérdező diák.
Mit tehetünk mi, felnőttek, szülők, tanárok, hogy gyermekeinkkel megkedveltessük a könyvet? Bizonyos, hogy a folyamat a mesével kezdődik. A gyerek, aki megszokta, hogy a szülei mesét mondanak vagy olvasnak fel esténként, igényelni fogja a napi feszültségek elmúltával egy fiktív történet varázsát. Az olvasó gyermek így jut el majd Verne regényeihez, azután Jókai és Shakespeare izgalmas történeteihez; elbűvölik és mulattatják majd Rejtő Jenő alakjai.
Szakdolgozatom második része egyfajta szemüveget ad az olvasóra, amelyen keresztül mesék, regények, krimik kémiai vonatkozásait lehet megvizsgálni. Hogyan lehet ezt hasznosítani a kémiaórák keretein belül? A kémiatanár ezzel két célkitűzésnek tehet eleget: népszerűsítheti az olvasást, az irodalmat – ennek a magyar szakos kollégák is csak örülhetnek –; másrészt, ami számára fontosabb, saját tantárgyát is kedveltté teheti.
3.1. Az ókor irodalma
A kilencedik osztályos tananyag általában sok problémát okoz a tanulóknak. Az anyag atomos szerkezete, az atomok felépítése, a héjak, az alhéjak, a párosítatlan elektronok és a kötéstípusok értelmezése rengeteg fejtörést – esetleg álmatlan éjszakákat – okoz. Ezzel az ókori görögök és rómaiak sem voltak máshogy.
A görögök természettudományában érdekes szerepet töltött be a kémia. A matematikában jól bevált deduktív módszer – a matematikai gondolkodás – háttérbe szorította a gyakorlati megfigyeléseket, a kísérletezést. (De azt már a gyerekek is tudják, hogy nincs kémia kísérlet nélkül…)
A tudomány egyik fő kérdése az volt, hogy miből és hogyan épül fel az anyag, amely a világot alkotja. Erre több elgondolás is született. A világ felépülhet a négy őselemből: földből, tűzből, levegőből, vízből; vagy ezek közül csak néhányból; de akár „magokból”, vagy oszthatatlan parányi részekből: atomokból is.
A korai, a Kr. e. 4. századi atomelmélet legnevesebb képviselője Démokritosz volt – nevével a 9. osztályos tankönyvben is találkozhatunk. Elmélete szerint az atomok a legkisebb, tovább már nem osztható részek, azonos anyagúak, csak méretükben és alakjukban térnek el egymástól, és keveredésükből jönnek létre a különböző testek. Ám amíg az atomok létének felfedezése viszonylag egyszerű volt, sokkal nagyobb feladatot állított a tudósok elé, hogy miként lehet ezekből a kicsiny részecskékből a világot felépíteni, és ezáltal hogyan magyarázhatók az anyagok különböző tulajdonságai.
Démokritosz elmélete kiváló terjesztőt talált a háromszáz évvel később élt római költőben, Lucretiusban. Lucretius leghíresebb művében, a De rerum naturaban összegyűjtötte az őselem-elméleteket, véleményt mondott róluk, majd bemutatta az atomelmélet legfontosabb gondolatait. A következő idézetben arra láthatunk példát, hogy az atomok különféle elrendeződéseiből hogyan kaphatjuk meg az egymástól annyira különböző anyagokat.
(A gyerekek számára nehézkes lehet a hexameterek olvasása, úgyhogy inkább csak bátrabbaknak ajánljuk!)
„Így jól általláthatod azt, hogy az őselemek mely
Testekkel s hány meg hány helyzetben keverednek,
S egymás közt mily mozgást tesznek s vesznek az űrben.
S láthatjuk, hogy az őselemek se nyugosznak örökké.
Mert hisz a dolgok külseje is mindegyre megújul,
Néha meg elmúlnak, majd ismét újraszületnek.
Sőt: látjuk, hogy a verseknél is mennyi sokat tesz,
Hogy betüik mivel és mily helyzetben keverednek.
Mert azonos jelek alkotják az eget meg a tengert,
Földet, napfényt, termést, állatokat s a folyókat,
És ha nem is minden jel, a legtöbb része hasonló,
Úgyhogy csak rendjük tesz más-más elnevezést ki.
Így ha a dolgok anyagjának felbomlik a rendje,
És mássá lesz bennük a mozgás s összeverődés,
Akkor a dolgoknak meg kell változni ugyancsak.”
Kilencedik osztályban, az anyagszerkezet és az atom felépítésének tanításakor a De rerum natura idézeteinek segítségével bátoríthatjuk tanulóinkat azzal, hogy nem csak nekik nehéz a kémia tanulása, ezzel az ókori emberek sem voltak másképp. Érdekes lehet visszatérni Lucretius művéhez a tizedik osztályban, a szerves vegyületek felépítése, a konstitúciós izoméria témakörben.
Lucretius művében az anyagmegmaradás törvénye is megjelenik.
„Így nem vész el, bár úgy tűnik, semmi egészen,
Mert hisz a természet mindent mássá alakít csak,
És újat nem szülhet más, csak a régi halála.
Most, hogy feltártam: semmit sem szülhet a semmi,
És ami megszületett, nem térhet a semmibe vissza,
Mégis azért, hogy kételkedni ne kezdj szavaimban,
Hogy nem láthatjuk meg az ősanyagot szemeinkkel,
Halld, és ismerd el magad is, hogy vannak a dolgok
Közt olyanok bőven, melyeket nem láthat az ember.”
Bár a középiskolai irodalomanyagban nem szerepel Lucretius költészete, az ókori szerzők költeményeivel, például Homérosz műveivel már találkoztak a gyerekek – és talán még nem felejtették el teljesen…
3.2. Mesék
Gyermekkorunk meghatározó élménye volt, amikor szüleink vagy nagyszüleink az ölükbe ültettek bennünket és mesélni kezdtek. A szegény legényről, aki feleségül vette a király legkisebb lányát; a ravaszdi rókáról, aki mindig becsapta az oktondi állatokat; az okos parasztról, aki még az ördög eszén is túljárt; és a kis Mukk kalandjairól sem feledkezhetünk meg. Ám a legtöbb mese nem csak a kisgyermekeknek szól, gondoljunk csak Milne Micimackójára vagy Saint-Exupéry kis hercegére.
Bizonyos, hogy a középiskolába járó korosztály is fogékony a mesékre. Még a kémiaórák keretein belül is.
3.2.1. Népmesei motívumok
„Egyszer volt, hol nem volt, az Óperenciás tengeren túl, az Üveghegyen túl, ahol a kurtafarkú malac túr, élt egyszer egy öreg király. Volt az öreg királynak három palotája: egy ezüstpalota, egy aranypalota és egy gyémántpalota […]”
Képzeletbeli mesénk akár így is kezdődhetne. A mesék keletkezésének pontos időpontját nem tudjuk. Senki nem tudja. A történetek szájhagyomány útján terjedtek, és csak a múlt század végén, a század elején kezdték lejegyezni őket. Számunkra viszont most nem ez a legfontosabb tudnivaló. A magyar népmesék és más népek meséinek közös tulajdonsága az, hogy kimondatlanul bár, de nagy szerepet kap a kor – a népmese keletkezési korának – anyag- és elemismerete. Milyen anyagok szerepelnek a mesékben? A legtöbbször használt fémek: az arany, az ezüst, a réz; a legkeményebb és talán legértékesebb anyag: a gyémánt; különböző mérgek, csodaszerek, gyógyszerek – bár ez utóbbiak nagy része csak a képzelet szüleménye.
A népmeséket és a bennük rejlő ismereteket a szervetlen kémia tanításánál, az egyes elemek, vegyületek bemutatásánál érdemes felhasználni.
3.2.2. A méregkeverő Grimm-testvérek
„[…] A királyné felugrott ültéből, és mérgében majdnem a falhoz csapta igazmondó varázstükrét. Mikor aztán kissé lecsillapodott az indulata, töprengeni kezdett, forralta magában az egyik gonoszabb tervet a másik után, míg végül meg nem állapodott a leggonoszabbnál. Értett a boszorkánymesterséghez, bezárkózott hát a kotyvasztó-műhelyébe, tüzet rakott, pépet kavart, és fabrikált egy mérgezett fésűt. Mikor azzal elkészült, megint fölöltözött vénasszonynak, megint bekente hamuval az arcát, megint befestette szürkére a haját, megint ládikát akasztott a nyakába, de most még sokkal vénebbnek, sokkal törődöttebbnek látszott, mint a múltkor. Botot fogott a kezébe, és mintha hibás volna a lába, sántikálva indult a hegyen át a hét törpe háza felé […]
[…] Hófehérke leült egy zsámolyra az öregasszony lábához, és odatartotta neki a fejét. De alig merült a fésű ébenfekete hajába, hatni kezdett a méreg, és a lányka eszméletlenül hanyatlott a földre. Nagyot kacagott a gonosz királyné, és elégedetten dörzsölte a kezét.
– No, te világszépe, most aztán megjártad! – mondta kárörömmel, és kisietett a házból.
Csakhamar hazajöttek a bányából a törpék; meglátták a földön Hófehérkét, és tüstént tudták, hogy megint a mostohaanyja járt ott. Nosza, keresni, kutatni kezdtek; megtalálták a hajában a mérgezett fésűt, fogták, tűzbe dobták; mire elégett, Hófehérke is magához tért ájultából. Elmondta, mi történt vele, a törpék pedig újra lelkére kötötték, ki ne nyissa többé senkinek az ajtót […]
[…] Túl a boszorkánykonyháján volt a királynénak egy még titkosabb kis kamrája, abban tartotta a legöldöklőbb mérgeket, ott készítette elő legfélelmetesebb fondorlatait. Parancsba adta az udvari népnek, hogy senki ne merje háborgatni, hozatott magának egy hibátlan, szép almát a királyi kert legszebb almafájáról, és bezárkózott vele ebbe a titkos kamrájába. Ott nekiült a munkának, dolgozott egész nap, egész éjjel, fölhasznált minden fortélyt, összeszedte minden tudományát, s addig föl se kelt a boszorkányasztala mellől, míg az alma piros felét át nem itatta gyilkos méreggel […]
[…] Hófehérke nézegette, forgatta a pirospozsgás fél almát, szerette volna is, meg nem is; de mikor hallotta, milyen jóízűen harsan a gyümölcs friss húsa a menyecske foga alatt, ő sem tétovázott tovább, szájához emelte és beleharapott. S abban a pillanatban holtan esett össze […]”
Az emberek szeretik a titokzatos, misztikus dolgokat, ezért találták ki a meséket. Egy mesében pedig minden megtörténhet: a szegény fiúból királyfi lehet, az egyszerű ember megtalálja az örök fiatalságot adó italt, az okos parasztember túljár az ördög eszén, és a gyilkos méreg nem öli meg az ártatlan királylányt.
Grimm meséje lehet a példája annak, hogy a királyi udvarokban is van helye a laboratóriumoknak, még akkor is, ha ezeket a műhelyeket aranycsinálásra vagy éppen különféle mérgek készítésére használják. (A mérgek tulajdonságaival és a kémiaoktatásban való bemutatásukkal részletesebben a 3.5.2.1. fejezet foglalkozik.)
3.2.3. Aladdin és a csodalámpa
Ki nem szeretett volna otthoni használatra egy olyan szellemet, aki minden kívánságot teljesít? Főként akkor, ha az a szellem olyan látványosan bújik elő a palackjából, ahogyan azt az Aladdin rozsdás lámpájából előbújó dzsinn teszi. Ha szellemet nem is, a látványt kémiaórán is megteremthetjük.
6. KÍSÉRLET
Szükséges anyagok: 30–50 cm3 30%-os hidrogén-peroxid-oldat, negyed kávéskanál porrá tört kristályos kálium-jodid.
Eszközök: átlátszatlan csiszolt dugós edény, szűrőpapír, zsinór.
Végrehajtás: Öntsük a hidrogén-peroxid-oldatot az edénybe. A kálium-jodid port „csomagoljuk be” a szűrőpapírba, majd kössük meg jó erősen a zsinórral. Helyezzük a csomagot az edény nyakához belül, úgy, hogy a dugó tartsa a zsinórt, de a csomag ne látszódjék az üvegen kívül. Amikor eltávolítjuk a dugót, a csomag belehull a hidrogén-peroxid-oldatba. Néhány másodpercen belül egy exoterm reakció játszódik le a „palackban”, a kiáramló vízgőzben akár egy dzsinn is elbújhat…
Magyarázat: A KI katalizálja a hidrogén-peroxid bomlását, egy exoterm reakció megy végbe; vízgőz és oxigéngáz fejlődik. A reakció:
$$\mathrm{2\ H_{2}O_{2}\ (f)\ \xrightarrow{\ \ KI\ \ }\ 2\ H_{2}O\ (f)+O_{2}\ (g)+\text{ hő}}$$A reakció két lépésben megy végbe, átmeneti termék keletkezése közben.
\begin{align} \mathrm{H_{2}O_{2}+I^{–}} &=\mathrm{H_{2}O+IO^{–}} \\ \mathrm{H_{2}O_{2}+IO^{–}}&=\mathrm{H_{2}O+O_{2}+I^{–}} \end{align}Mikor varázsolhatjuk elő a szellemet a palackból? Igazából nap mint nap szükség lenne rá, de ha szigorúan követjük a tananyagot, akkor 9. osztályban, a redoxireakciók témakörében, vagy 11. osztályban, az oxigén és vegyületeinek részletes bemutatásánál kerülhet elő. Biztosan lesznek néhányan, akik lelkesen felkapják a fejüket és idézgetik a moziban látott rajzfilm általuk legérdekesebbnek tartott részeit…
3.2.4. Nicolas bűvészkedik
Gyermekkorunk kevesek által ismert, de annál népszerűbb mesehőse a francia kisfiú: Nicolas. Ő az igazi modern királyfi – kastély, ló és persze királylány nélkül –, akivel mindig történik valami. A francia kisiskolások olyanok, mint a magyar gyerekek: mindig baj van velük. Pedig hát, mint a báránykák. A kis Nicolas csak ül a padban, a többi ártatlan osztálytársával együtt, figyelnek a tanító nénire –, akinek majdnem mindig szót fogadnak –, s a végén a tanító néni majdnem mindig ideges lesz és az igazgató úr a fejét fogja. De hát ki tehet róla, hogy a szakfelügyelő beletenyerel a kiömlött tintába, s utána megsimogatja a homlokát?
Mi történik akkor, amikor barátunk meglátogatja az osztály legjobb tanulóját?
„[…] Nekem viszont nem nagy kedvem volt Agnanékhoz menni uzsonnára, sem pedig példát venni róla. Agnan az osztály legjobb tanulója, a tanító néni kedvence, viszont barátnak nem nagyon jó, de hát nem könnyű őt megverni, mert szemüveget hord […]
[…] Néztük, hogy mit is lehetne csinálni, és akkor Agnan mondta, hogy a természet tanulmányozására kapott apukájától egy kémiai játékot. Megmutatta, milyen klassz. Egy nagy doboz, tele csövecskékkel, spéci üveggömbökkel, kis fiolákkal, amelyekben mindenféle színes dolgok vannak, még spirituszfőző is volt a dobozban. Agnan azt állította, hogy mindezekkel rendkívül tanulságos kísérleteket lehet végezni.
Agnan beleöntött az egyik csövecskébe egy kevés port meg egy kis folyadékot, és akkor megváltozott a színe, hol piros lett, hol meg kék, s időnként egy kis fehér füst keletkezett. Hű de tanulságos volt! Mondtam Agnannak, hogy meg kéne próbálni még tanulságosabb kísérleteket végezni, s bele is egyezett. Fogtuk a legnagyobb üveget, beletöltöttük az összes kis porocskát meg a folyadékokat is, aztán elvettük a spirituszfőzőt, és elkezdtük melegíteni az üveget. Először nem volt rossz: habosodott, habosodott, aztán meg nagy füst lett belőle. Kár, hogy a füstnek nem volt valami jó szaga, és mindent összekoszolt. Kénytelenek voltunk abbahagyni a kísérletet, amikor az üveg szétdurrant.
Agnan meg elkezdett kiabálni, hogy nem lát semmit, de szerencsére ez attól volt, hogy a szemüvegének az üvege tiszta fekete lett. Amíg törölgette, én kinyitottam az ablakot, mert a füst nagyon köhögtetett bennünket. A szőnyegen a hab nagyon mókás dolgokat csinált, mint amikor forr a víz, a falak feketék voltak, mi meg, hát mi se voltunk valami tiszták.
És ekkor belépett Agnan anyukája…
Végül is anyunak lett igaza, mint általában: elég jól eljátszottam Agnannal. Én bizony szívesen elmennék hozzá megint, de pillanatnyilag azt hiszem, Agnan anyukája az, aki nem nagyon akarja, hogy barátkozzunk.
Mégiscsak jó lenne, ha az anyukáink eldöntenék végre, hogy mit is akarnak, az ember azt se tudja, kivel barátkozzon […]”
Mit önthettek össze a kis csirkefogók?
A mese felolvasása kémiaórán kissé hosszadalmas lenne, s a „nagy kilencedikesek” nem biztos, hogy kitörő örömmel fogadnák – persze, ha senki nem látja, otthon ők is olvasnak meséket. Éppen ezért Nicolas történetét házi olvasmánynak és házi feladatnak is fel lehetne adni. Hogy mi lehet a házi feladat?
A kilencedik osztályos tananyag egyik meghatározó része a protonátmenettel járó, más néven a sav-bázis reakciók részletes tárgyalása. Ha a gyerekek az alapvető fogalmakkal tisztában vannak, jó ismétlési lehetőség lehet számukra az, hogy kitalálják, mi történt a mesében szereplő kísérlet folyamán. (Persze, nem árt megjegyezni, hogy az író nem volt vegyész, tehát a leírt kísérletet nem kell – és nem szabad – szó szerint venni…)
3.2.5. Andersen meséi
Élt Dániában, valamikor a múlt század közepén egy fiatalember. Apja csizmadia volt, anyja koldusok gyermeke. A fiatalember nem akart hétköznapi, polgári foglakozást választani magának. Mivel szerette a szépet és a jót, és ezt meg is akarta mutatni az embereknek, egyszerűen csak írni akart. Meséket, boldog és szomorú történeteket; manókról, tündérekről, bodzafákról, cégtáblákról vagy csak egyszerű emberekről. Ám Andersen – mert ő ez a híres dán fiatalember – történeteit nem csak gyermekeknek szánta. Ki ne emlékezne a kis gyufaárus lányra vagy a Hókirálynő birodalmára?
Látszólag semmilyen kémiai vonatkozás nincs ezekben a mesékben. Vagy mégis?
„Volt egyszer egy derék, jóravaló ezüsthúszas. Gyermek szorongatta meleg kis tenyerében, fösvény zsugorgatta nyirkos, hideg markában, öregember pöngette-forgatta, ifjú gurította nagy gyorsan tovább. Ezüstből verték a húszast, egészen kevés rézzel vegyítették, s már egy álló esztendeje járta a világot, helyesebben azt az országot, ahol verték […]
[…] Nem nagy élvezet, ha átlyukasztanak bennünket, de ha jót akarnak vele, ki lehet bírni! Aztán zsinórt fűzött át rajtam, és nyakláncfélét csinált belőlem. A szomszéd kislány nyakába akasztott; a kislány kedvesen rám mosolygott, meg is csókolt, s egész éjjel ott feküdtem ártatlan, meleg kis szívén.
A kislány anyja reggel a kezébe vett, jól megnézett, s gondolt egy nagyot – ezt én mindjárt megéreztem. Vette az ollót, és elvágta a zsinóromat.
– Szerencsét hoz ez a pénz! – mondta. – No, majd meglátjuk.
Azzal ecetbe mártott, hogy egészen megzöldültem. Aztán betapasztotta a lyukat, kifényesített, s estefelé elvitt a lutripénztárba, szerencsehozó sorsjegyet vett értem […]”
Látható, hogy egy ezüsthúszas élete sem könnyű. Hát még ha nem tiszta ezüst… Honnan lehet ezt tudni? A fémezüst nem oldódik híg savakban, így ecetsav jelenlétében sem fejleszt hidrogéngázt. Mi lehet a pénzérmében az ezüstön kívül? A pénzverők leggyakrabban használt ötvözőfémje a réz. A réz sem oldódik híg savakban – p pozitív standardpotenciálja miatt –, ám oxigén jelenlétében híg szerves savakkal történhet reakció. Ez fordulhatott elő az ezüsthúszas esetében is.
$$\mathrm{Cu+2\ CH_{3}COOH+0,5\ O_{2}=Cu(CH_{3}COO)_{2}+H_{2}O}$$Érdemes a teljes mesét, vagy legalább egy rövid részletét felolvasni a 11. osztályban, a rézcsoport és elemei tulajdonságainak bemutatásakor: milyen reakciót várnánk a savakban való oldáskor a standardpotenciál alapján, és miért történik egyáltalán reakció a fémréz és az ecetsav, mint szerves sav között?
3.2.6. Kvantum Fantum csapdája
Mi köze lehet az elektronszerkezetnek a mesékhez, pláne a zenés mesejátékokhoz? Milyen egy vérbeli kémiai mese? Erre a kérdésre ad választ a Kvantum Fantum csapdája. A történet egy kalapács belsejében játszódik. A mese főszereplői: Ede, Eszter és Döme, három elcsavargott elektrongyerek. Bolyonganak a vasatom lakótelepen és hogy elűzzék félelmüket, énekelnek:
„Proton papa, neutron mama vár otthon ránk,
mert nélkülünk nem teljes a vasatom család.
Sok kis elektron testvér aggódik nagyon,
de hogy merre menjünk, azt nem tudom…”
Esztert elrabolja Kvantum Fantum elektronszippantója, ezért a két fiúelektron elindul, hogy kiszabadítsák testvérüket. Mivel egyedül nem képesek erre a feladatra, ezért Katát, az embergyereket hívják segítségül, aki egy varázsdal segítségével ugyanolyan pici lesz, mint az elektrongyerekek. Útjuk során legyőzik Kvantum Fantum szolgáját, a Hippitron főnököt, átkelnek a Potenciálhegyen és a Digitális Kanálison.
„Mert a Potenciál Hegyen túl,
ahol a kurta farkú pozitron túr,
csak én, csak én vagyok az úr!”
Kalandjaik után megérkeznek Kvantum Fantum birodalmába, aki gépével rögtön beszippantja az elektrongyerekeket, de Katára, mivel ő ember, nincs hatással. Így Kata ki tudja kapcsolni a gépet, kiszabadítja az elektronokat, Kvantum Fantum pedig elnyeri méltó büntetését.
A fárasztónak és unalmasnak tűnő atomszerkezet és elektronszerkezet órák üde színfoltja lehet ez a mesejáték. Csak arra kell vigyázni, hogy a gyerekek nem higgyenek el mindent, amit hallottak, értelmezni kell az elhangzottakat, hogy mindenki számára világos legyen, mi valóságos és mi csak a képzelet szülötte.
3.3. Természettudomány a szépirodalomban
3.3.1. A nagy mesélő: Móra Ferenc
A következő történet nem kémiai tartalma miatt került be a fejezetbe. Sokkal inkább azért, hogy ki-ki eldöntse, milyen a jó tanár, milyen a jó kémiatanár, hogyan érdemes tanítani, hogy mások, legfőképpen a gyerekek értékeljék a befektetett munkát. (A történet a XX. század elején játszódik.)
„Mindenkinek ád a sors fiatalkorában olyan kalandot, amire még öregen is szívdobogva emlékszik vissza. Az én fiatalságomnak az volt felejthetetlen kalandja, hogy egy esztendeig inasiskolai tanító voltam […]
[…] Egyszer vaktában kinyitottam a könyvet valahol: A szóda című olvasmányra nyitottam. Aztán vaktában rámutattam egy egérképű inasra.
– No, olvasd!
A gyerek addig olvasott, hogy a szóda legfinomabb fajtája a kalcinált szóda. Ezt aztán olvasta kanciláltnak, kancsiláltnak, és csak azért nem tört ki a nyelve szegénynek, mert engem elfutott a düh.
– Milyen inas vagy te, fiam?
– Szabóinas.
Hát a keserves poncius-pilátusát annak a m. kir. állami iparoktatási szaktudománynak!… Hát minek kelljen azt tudni egy istenadta szabóinasnak, amit az egész magyar képviselőház és főrendiház együtt sem tud!…
Az én vizsgabiztosom nagyon tekintélyes ember volt […]
[…] A váratlan fordulatot maga a vizsgabiztos provokálta ki, aki nagy emberek szokása szerint elkapatta magát a hatalom által.
– Szamár vagy! – harsogott le ránk a tekintély a katedráról. – Miért írtad a májust kis m-mel? Még azt se tudod, hogy a személyneveket nagybetűvel írják?
Addig csak keresztben feküdt bennem az ördög, de most már talpra ugrott. Hát te akarsz nekem imponálni, te arannyal megpántolt kukoricagombóc? No, majd én imponálok neked úgy, hogy megrepedsz bele!
Kiintettem egy szemfüles borbélyinast.
– Te tudod, mi az a kalcinált szóda? Ugye? – néztem rá erősen.
A gyerek rám bámult, de ahogy a szemem sarkával odavágtam neki, bátran megfelelt:
– Tudom. Az az erős szóda.
– Úgy van – bólintottam rá. – Hát mit csinálnak abból az erős szódából?
Magam is kíváncsi voltam rá, mi a fütyülő fülemülét lehet erre felelni. El voltam rá készülve, hogy mindent ráhagyok, akármit talál ki.
– Spirituszt.
– Bravó! – hajolt előre a katedráról a nagyember. Tudtomra akarta adni, hogy ő is tudja ám ezt.
Erre aztán egészen vérszemet kaptam.
– No, most már írjuk föl a spiritusz vegyképletét. 2… számmal írd a kettőt, te kófic.
– Na, tovább, ahogy következik!
– D…
– A számot is mellé, ahogy következik!
– $\mathrm{D_{3}\ E_{4}\ F_{5}\ G_{6}\dots}$
– Elég, mehetsz a helyedre – vágtam közbe, mert attól féltem, ki fog derülni, hogy a kalcinált szóda tudósa nem egészen biztos az ábécében.
A csatát megnyertem. A nagyember lejött a katedráról, és amennyire nagy hasa és kurta karjai engedték, megölelt az inasaim szeme láttára.
– Tanár úr, engedje meg, hogy elragadtatásomnak eleget tehessek. Húsz éve járok inasiskolai vizsgákra, de szavamra mondom, ilyen művelkedést még nem tapasztaltam.
Igazán nem tehetek róla, hogy talentumom hírével egyszerre telekürtölte a szakköröket, és amikor másnap leköszöntem az állásomról, küldöttséget vezetett hozzám, hogy vonjam vissza a lemondásomat. De mivel hajthatatlan voltam, legalább díszdiplomát adtak róla, hogy az inasoktatás ügye legfőbb oszlopát vesztették el bennem […]”
3.3.2. A természettudós író: Jókai Mór
„A tudóstársaságnak egyik legtekintélyesebb tagja mosolygó iróniával fejezé ki bámulatát afölött, hogy tisztelt kollégája mennyi poézist bírt kihozni e tudományos tárgyból; míg egy szintén igen tekintélyes költőnk sajnálkozását tudatá vele, hogy költői tárgyban miért engedte fantáziáját száraz tudományos adatok által korlátoztatni.”
Azok számára, akik életükben legalább egyszer végigolvastak egy Jókai-regényt, nyilvánvaló, hogy Jókai nem csak remek író, hanem korának kiváló természettudósa is volt. Regényeiben nem csak a kémiatanárok találhatnak felhasználható idézeteket, hanem fizikát, biológiát, földrajzot vagy akár történelmet tanító kollégáik is kedvükre válogathatnak a kor- és tudománytörténeti csemegének számító írásokból.
Tudományos szemmel vizsgálva Jókai talán legsokoldalúbb műve a Fekete gyémántok. Nézzük meg, milyen érdekességeket találhatunk benne.
Az első regényrészlet kémia- és tudománytörténeti vonatkozásai különleges.
„Abba a kis oldalkamrába pedig még csak betekinteni sem enged senkit, mely vegytani műhelyét képezi.
Ki is értené e rejtélyes műszerek hivatását az őt környező emberek közül? Mit világít meg Locatelli lámpája? Mit számít fel Lavoisier tűzmérője, Berard gázhőmérték-hasonlítója? Mit tanít a csodateljes napspektrum? Mit mível a Bunsen-villanygép, mely a vizet elemeire felbontja? Mi lakik Wollaston villanytelepében? Mit idéz elő a hővillany-oszlop? És az a számtalan, csak a beavatott előtt felfogható titokszerű üst, katlan, lombik és kemence, a szublimáló süvegkályha, az átlátszó üvegbuzogányok agyaggyűrűiken, Berzelius vegytani mérlege. Woulff kéklő-leszűrője, az élenyfúvó éterlámpa, a folyékony széneny lehűtője, a villósűrítő cső, a kálium kemence, a zöldlőmeszenycsöveg, Marsh mirenykémlője, az elemvegybontó edények és mindezek között a legtitokszerűbb lény maga az, aki éjeket eltölt közöttük, vajon mi szüksége van neki mindezekre?”
„Hanem a csónakász most nem ügyel sem a víztükörre, sem a falak titkos jegyeire; csupán a légbe néz fel komoly aggodalommal, s sodronylámpáján vizsgálja a zárat, ha nem nyílt-e fel. A lámpa ezúttal nagy gőzudvart mutat maga körül. A lég valami kékes borulatot vesz fel a föld alatti éjben. A csónakász tudja, hogy mi az!
A sodronylámpában folyvást sziporkázik a láng, néha nagyokat lobban a mécsbél, s a sodrony izzó kezd lenni, és vörösen világít…
Két rém lakik a kőszénbányák üregeiben; két ádáz szellem, a halál szolgái. Az egyik a »zuhatar«, a másik a »viheder«. A viheder csak suhanva jön, fojtó nehéz párájával elüli a mellet, együtt jár-kel a dolgozókkal, megnémítja nyelveiket; jelen van munkáiknál, kitart velük, gyönyörködik rettegéseikben, s ha jól megtanította őket imádkozni, akkor elül, eltávozik, visszahúzódik odújába. Hanem a zuhatar rettenetes! Az rohanva jön, lángot robbant, meggyújtja maga körül a tárnát, boltozatot tör, aknát vettet, földet omlaszt, embert pozdorjává tör. És azután a vihedernek is csak egy szikra kell, hogy zuhatarrá váljék. Csak egy Davy-lámpának könnyelmű kinyitása, mellyel valaki tréfából pipára gyújt. Azzal vulkánt gyújtott maga körül.
A magános férfi növekedő aggodalommal látta maga körül a léget egyre opálszínűbbé tömörülni; egész ködöt képezett már az körülötte.
A lég, mely keblüket elfojtja, melynek szagát érzik, mely lámpáikat egész a sodronyhenger tetejéig szokatlan tűzzel megtölti, a túlvilág lehelete, a halál kevegője az; nem kell hozzá, csak egy szabad szikra, és mindazok, kik most itt élnek, halva és temetve vannak, s odafenn száz özvegy és árva sír a fejük felett. A Davy-lámpák mellettük egész színültig fényes lánggal töltve, melyen keresztül az olajmécs-bél, mint vörös széndarab, izzik, az ott a halálvész lángja, mit csupán a sodronyhenger (ez a tűz börtöne) tart fogva; a sodrony is izzó vörös, de azért fogva tartja a tűzszellemet, mint Salamon király gyűrűje a démont […]”
„Nem merte azt senkinek mondani, mert ha közölné gondolatját munkásaival, akik eddig minden vészen keresztül követték, egyszerre visszafordulnának, és futva igyekeznének a szabad légre feljutni. A Davy-lámpák sodronyhengere színültig van telve vörös lánggal, ami azt hirdeti, hogy még mindig egyharmad rész a könlég a tárnában, csak kétharmad az éltető lég: a többi halálgőz.
De a bányagáztól már nem félnek. Ennek a rettenetes szellemnek fényárasztó szemeibe megszoktát bátran belenézni. Még akkor is, midőn szétroncsolt ádozatainak tetemeit rakják a hordágyra. De van egy másik szellem, aki lehunyt szemmel jön. Azzal nem mert találkozni senki. Az a szénlég a bányában. Annak a jelenléte rettenetes! […]”
Mi lehet az a titokzatos Davy-lámpa?
Történelmi tanulmányainkból tudjuk – és talán a tanulók is tisztában vannak ezzel –, hogy a 18. század közepe az ipari forradalom kezdete – ezzel kapcsolatban mindenki óhatatlanul a szénre és kokszra, a vasra és acélra gondol. Milyen problémák merülhettek fel? Szükség volt újabb energiaforrásokra és nyersanyagokra. Az eddig mindenütt rendelkezésre álló fa kifogyóban volt; célszerűnek tűnt a kőszén alkalmazása. Ám a kőszén bányászatával és felhasználásával kapcsolatban újabb problémák adódtak.
A szén kéntartalma égéskor kén-dioxiddá alakul, s ez a szúrós szagú gáz nem csak mérgező, hanem korróziót is okoz. (Azt már a 17. századi sörfőzők is tudták, hogy a maláta szárításához, pörköléséhez és a sörfőzés más műveleteihez használt kőszén kéntartalma miatt kellemetlen mellékízűvé tette a sört.) Meg kellett tehát szabadítani a kőszenet a szennyező anyagoktól; erre egy lehetséges megoldás volt a szén zárt térben való hevítésével történő koksz előállítása.
Ám a felhasználáshoz a szenet ki kell bányászni! Ez pedig nem annyira egyszerű, mint amilyennek első ránézésre látszik. A „Mind több szenet!” jelszónak az lett az eredménye, hogy a bányákban a szén fejtése mind hosszabb és mélyebb, föld alá nyúló tárnákban folyt, viszont ez a bányászokat újabb problémák elé állította, és fokozott veszélyeket rejtett. A bányák mélységének növelése a bánya levegőjének elhasználódását és szennyeződését is meggyorsította; a robbantások, amelyekkel a fejtést elősegítették, és az így előtörő mérges gázok a levegőt csakhamar alkalmatlanná tették arra, hogy ott szellőztetés nélkül a munkát tovább folytassák; szivattyúzás nélkül pedig a bányát elöntötte volna a víz. Newcomen, majd Watt gőzgépe szerencsére lehetővé tette a bányavíz gyors és megfelelő kiszivattyúzását és a nagyobb hatásfokú szellőztetőgépek működését.
A bányák mélye azonban mást is tartogatott: a mélységgel együtt a sújtólég veszélye is megnőtt. A főként metánból álló, a szénrétegek közül előszivárgó és időnként hirtelen előtörő gáz a bánya levegőjével keveredve sokszor robbanást idézett elő; legtöbbször egy picinyke szikra is elegendő volt a szerencsétlenség bekövetkezéséhez. A bányalég elhárításának kérdése nem egy szakembert foglalkoztatott. Azt már korábban észrevették, hogy a világításra használt mécses lángja furcsán megnyúlik a sújtóleget tartalmazó levegőben. Sokszor azonban későn vették észre a veszélyt, vagy éppen a láng indította el a robbanást. Több, többé-kevésbé sikeres próbálkozás után Sir Humphry Davy fejlesztette ki a később róla elnevezett lámpát, amely alkalmas volt a világításra, és egyben biztonságosan jelezte a sújtólég jelenlétét. Davy megállapította, hogy az égéshez három feltétel szükséges: éghető anyag, égést tápláló közeg (általában ez a levegő) és gyulladási hőmérséklet. Kísérleti lámpája lángját üveg- és fémcsöveken át vezette a robbanótérbe, és azt tapasztalta, hogy ha a lángot finom fémszálakból szőtt hálóval veszi körül, akkor csak a hálón belül következik be robbanás, amely el is oltja a lángot. Ennek az az oka, hogy a robbanáskor keletkező hőt, amely a külső térben is beindítaná a folyamatot, a jó hővezető fém elvezeti, ezáltal a hőmérséklet a külső térben nem éri el a gyulladási hőmérsékletet, így a robbanás elmarad. Viszont mozgatás hatására a láng a fémhálót átizzíthatta, s ekkor már nem volt biztonságos a használata. A megoldást egy egyszerű ötlet adta: a lángot kettős fémhálóval kell körülvenni.
(Davy vizsgálatai azt is kiderítették, hogy a metán-levegő elegy csak meghatározott összetételnél robbanásveszélyes, éppen ezért megfelelő szellőztetéssel a sújtóléggel szennyezett területen a veszély megszüntethető.)
A regény még más érdekességeket is rejteget.
„Nem mondunk vele semmi újat, ha felfedezzük, hogy a »fekete gyémántok« alatt értjük a kőszenet. A gyémánt sem egyéb, mint égeny, jegec alakú szénanyag; a kőszén is az, csakhogy az átlátszó, emez fekete.”
„– Grófnő, bizony ez a tükör nem toalettem rendbehozására szolgál; hanem ez egy úgynevezett gyútükör, melyet olyan vegytani műtételnél használunk, ahol a legbehatóbb tüzet akarjuk előidézni.
Az apát úr be akará bizonyítani, hogy ő is jártas a természettudományokban, s beleszólt:
– Például a gyémánt elégetéséhez.
– Igen – helyeslé Iván. – Ahhoz is a gyútükröt használjuk, a gyémánt csak abban ég el, meg a ropp-gáz lángjában.
– Hogyan? – szólt kíváncsiságot tettetve a grófnő Ivánhoz. – Ön azt állítja, hogy a gyémánt eléghető volna?
– Eléghető biz az, grófnő, mert nem egyéb, mint szén kristályalakban! S a beható tűzben a patricius gyémántból minek karátja 90 forint, s aztán minden további karátnál köbös emelkedésben nő a becse, éppen az lesz, ami a plebejus szénből: szénéleg, láthatatlan gáz. Ezt bizonyítja a gyútükör tűzpontja.
Iván egy kis fogóval kivette a követ a jour foglalatjából, s egy vastag, lapos agyagtégely homorú fenekére helyezé.
Azután kinyitotta az ablakot, hogy szabadon jöhessen be a napsugár.
A tégelyt, melyen a gyémánt feküdt, egy kis ércállványra állítva, odatette a szoba közepére a grófnő elé.
Maga pedig fogta a gyútükröt, és kiment vele a szabadba, mert benn a szobában az ablak keresztfái miatt nem eshetett volna teljesen a napsugárzat a gyútükörre.
Iván künn az ablakból, eltalálva a sugárverés legkedvezőbb helyét, ráirányzá a tégelyre a gyútükör sugárgúlájának hegyét. A gyémánt ezernyi szikrát szórt e megsemmisítésére törő napsugárkatlanban, s pillanatokig úgy látszott, mintha ő maradna e harcban a győztes, minden rálövellt nyilát a napsugárnak a szivárvány hét színére törve össze; hanem a gyútükör tűzösszpontja egyre szűkebbre szorult körülötte, s egyszerre vakító napfény töltötte meg a kis szobát, oly világló, hogy ezüstnek látszott benne minden tárgy, s elenyészett benne minden árnyék.
Egy tűzkarika lövellt szét a tégelyből, villámnál világlóbb nyilakat szórva maga körül, s a következő percben megszűnt a gyútükör működni.
Iván még ott állt künn az ablakban. Onnan kérdezé a szobában levő grófnőtől:
– Mi maradt a tégelyen?
– Semmi.”
Lavoisier, a neves XVIII. századi francia tudós nevéhez fűződik az a „hihetetlen” kísérlet, amivel hatalmas meglepetést okozott nézőinek, ez a gyémánt elégetése. Eddig a gyémántot mint drága , nagyon kemény – a legkeményebb az ismert anyagok közül – és kémiailag rendkívül ellenálló anyagként ismerték. Az elégetésre irányuló kíséretek sorra azt az eredményt adták, hogy a gyémánt nem égethető el, de ha sikerült is „eltüntetni” a drágakövet, akkor arra a következtetésre jutottak, hogy elpárolgott. Viszont a kísérlet sikerült, és Lavoisier az égéstermékről azt is kimutatta, hogy az megegyezik a közönséges szén elégetésekor keletkező gázzal, tehát a gyémánt is szén!
Ma már tudjuk, hogy az elemi szén két legismertebb allotrop módosulata a gyémánt és a grafit.
A gyémánt atomrácsában a szénatomok egyenlő távolságban, tetraéderesen helyezkednek el, a rácsban a kötést létesítő elektronpárok lokalizáltak, ezért a gyémánt nem vezeti az elektromos áramot: szigetelő; kemény, színtelen és nagy fénytörő képessége.
A grafit síkrácsos, réteges szerkezetű. Az egyes rétegekben hatszögekből felépített síkrácsok vannak, ezekben a szénatomokhoz három másik kapcsolódik egyszeres σ-kötéssel, a negyedik elektron a delokalizált π-kötésben vesz részt, ennek következménye az, hogy a grafit szürkésfekete színű (az elektronok gerjeszthetősége miatt) és jól vezeti az elektromos áramot. Mivel a síkok között másodrendű kötés van, ezért ezek már kis erőhatásra is elcsúszhatnak egymáson, éppen ezért a grafit puha, könnyen hasítható, nyomot hagy a papíron.
A szén harmadik, legkésőbb felfedezett módosulatai a fullerének. A fullerének fekete színű, fémes fényű, kristályos anyagok, amelyekben 60 vagy 70 szénatom alkotja a focilabda alakú molekulát. (Képletük: $\mathrm{C_{60}}$ vagy $\mathrm{C_{70}}$.)
Mivel a gyémánt, a fullerének és a grafit is tiszta, elemi szén, ezért égésük is ugyanúgy történik.
$$\mathrm{C+O_{2}\ \rightarrow\ {CO}_{2}}$$Jókai egy kevéssé ismert történelmi regénye a Fráter György. Talán nem található benne annyi kémiai vonatkozás, mint a Fekete gyémántokban, de érdekességeket itt is találhatunk.
„Úgy lett a terv megállapítva, hogy majd a nagy búcsúlakománál Péter vajda elé egy aranyserleget tesznek, melynek a belseje azzal a finom méreggel van zománcolva, mely csak napok múlva érezteti pusztító hatását…
Mikor éppen az első serlegtöltés sora jött, hozott egy apród Fráter Györgynek egy sürgős levelet. A püspök engedelmet kért a királytól, hogy azt feltörvén, ott az asztalnál elolvashassa.
A levél olvasása közben folyton növekvő felháborodás látszott az arcán, hol az írásba, hol a vajdára nézett, s midőn Péter vajda éppen a serleg után nyúlt, hogy azt János király egészségére ürítse, hirtelen megragadta a vajda kezét, s rémülettől reszkető hangon kiálta.
– Vajda! Ne igyál abból a serlegből! Az meg van mérgezve!
S azzal felkapva a billikomot, kiönté abból a bort a háta mögé. Rémséges volt azt látni, mikor a márványpadlón szétloccsanó bor, a benne lévő gyilkos méregtől elkezdett sisteregni, s gőzt bocsátott magából. (Ezt különben a márványra, mint mészkőre öntve, minden savanyúság megteszi.)”
Egy könnyen, a gyerekek által is megvalósítható kísérlettel szemléltethetjük a gyilkos bor által a márványpadlón előidézett folyamatot. Mivel márvány általában nem áll a kémiatanárok rendelkezésére, ezért kísérletünkhöz a lehető legolcsóbb kalcium-karbonát-forrást használjuk fel: a tojást.
7. KÍSÉRLET
Szükséges anyagok: 2 mol/dm3 koncentrációjú sósavoldat, tojáshéj.
Eszközök: 250 cm3-es főzőpohár, csipesz.
Végrehajtás: Egy kisebb darab tojáshéjat tegyünk egy 2 mol/dm3 koncentrációjú sósavoldatot tartalmazó főzőpohárba. A tojáshéj pezsgés közben reagál a sósavval.
Magyarázat: A tojáshéj jelentős mennyiségben tartalmaz $\mathrm{CaCO_{3}}$-ot, ez reagál a sósavval:
$$\mathrm{CaCO_{3}+2\ HCl=CaCl_{2}+CO_{2}\uparrow+H_{2}O}$$Mikor olvashatunk fel Jókai regényeiből? Az író regényei szinte az egész középiskolás tananyagot végigkövetik. Egy lehetséges szorgalmi feladat: utánanézni a regénybeli szakkifejezések (például szénlég vagy mirenykémlő) pontos jelentésének. A Davy-lámpáról szóló részletet idézhetjük 10. osztályban, a szén-hidrogének homológ sorának tárgyalásakor vagy a metán tulajdonságainak bemutatásakor, de akár egy évvel később, a szén és tulajdonságainak megismerése után is – ekkor olvashatjuk fel a gyémánt égetéséről szóló részt is. A György barát életéről szóló regényrészletekre 9. osztályban, a sav-bázis reakciók tárgyalásakor, vagy két évvel később, a kalcium és vegyületei, a kalcium-karbonát bemutatásakor kerülhet sor. Hogy az órán történik-e a felolvasás, vagy a házi feladat egyik része lesz az, hogy a diákok elolvassák az adott regényrészletet és gondolkodjanak róla; a kiválasztás a tanár dolga – persze a gyerekek hozzáállásán is múlik…
3.3.3. Csíkok az irodalomban
A néhány évtizeddel ezelőtt közkedvelt, és napjainkban ismét reneszánszukat élő „lányregények”, ismertebb nevükön a csíkos és a pöttyös könyvek is tartalmaznak kémiai szempontból figyelemreméltó dolgokat. Kertész Erzsébet egyik történelmi vonatkozású regényében találtam ezt a néhány sort.
„Hosszú hetek teltek el, míg végre Emmától Drezdából levelet kaptak. Klára elsápadt, amikor a fekete szegélyes levelet meglátta… Blanka is fehér lett, amikor a borítékra nézett.
– Ki halt meg – gondolta zúgó fejjel, lüktető halántékkal –, valamelyik gyerek vagy Ágost?
Mozdulatlan arccal olvasta el a levelet. Aztán szótlanul átnyújtotta Klárának. Klára reszketve nyúlt utána, de a papírlap kihullt a kezéből. És ahogy utána kapott, fejét beverte az asztal sarkába. A bőr felrepedt halántékán, és dőlt belőle a vér… A levél a földön feküdt, a szép, egyenletes gyöngybetűkön vércseppek piroslottak. Blanka felemelte a levelet, zsebkendőjével letörölte róla a vért.
– Ágost meghalt – mondta végül Blanka, amikor annyira erőt vett magán, hogy meg tudott szólalni. – Emma Drezdában találkozott vele, két hétig voltak mindössze együtt, aztán meghalt. De hogy hogyan halt meg, ezt Emma nem írja, nem írhatja le…
Klára felemelte a fejét. A levélre nézett, amelyen a letörölt vércseppek alatt halvány vonalakat látott.
– Ó, hiszen ebben a levélben a sorok mögött egy másik levél is van! – kiáltott fel. – Nézze csak, grófnő, ott, ahol vér érte, és egy kis meleget kapott, halványan előbukkant az írás! Vegytintával, vagy lehet, hogy egyszerűen citromlével írta Emma grófnő a sorokat! Ha meleg éri a vegytintás írást, olvasható lesz! Mindjárt tüzesítek vasalót, és átvasalom a levelet!…
Klárának igaza volt. A sorok között újabb sorok tűntek elő. Ezekben a sorokban írta le Emma, hogy Ágost, a szerencsétlen végű győri csata után elégette a nemzeti zászlót, hogy ne kerüljön idegen kézre […]”
A történelem egyes időszakaiban – például a regénybeli, a szabadságharcot követő időszakban – újra és újra felbukkantak a titkosírás különböző változatai. A történelmi hátteret ismerve szükség is volt különféle láthatatlan tinták készítésére és használatára, ám a helyzet kissé ellentmondásosnak tűnik. Ha mindenki ismerte a tinták és levelek „titkát”, akkor a hatóságok miért nem?…
Mi a láthatatlan tinták titka? Varázslatos viselkedésük egyszerűségükben rejlik. Mi is készíthetünk mások számára hozzáférhetetlennek tűnő írást? Persze. Csak egy kis ecet, citromlé, kristálycukor vagy káposzta kell hozzá. A többi már gyerekjáték.
Teleki Blanka tintája egyszerű citromlé volt. Ha citromlével – lehetőleg citrom kifacsart levével és nem a boltban kapható azonos nevű folyadékkal – írunk papírra, akkor az száradás után láthatatlanná válik, majd enyhe melegítés után (például egy gyertya lángja) már olvashatjuk is a barna sorokat. Mi történik? Melegítés hatására a citromsav és a papírlapban lévő cellulóz is barna színnel elbomlik, viszont a citromsav bomlása gyorsabb, ezért az írás előbb barnul meg, mint a papírlap.
Más szerves savakkal is dolgozhatunk. Minden háztartás nélkülözhetetlen kelléke az ecet. Az ecetsav tintaként ugyanúgy viselkedik, mint a citromlé, ám jellegzetes szaga miatt sokkal könnyebb felismerni.
Hasonlóan működik a cukoroldatból készült tinta. Szűrőpapírra nem érdemes levelet írni, mert szétfolyik a felületén, így sokkal több helyet foglal el; viszont ha az általánosan használt papírokra írunk a cukortintával, akkor vigyázni kell, hogy nagyon-nagyon híg legyen a használt oldat, mert ellenkező esetben csillogni fog a papír felületén, s megfelelő fényviszonyok mellett melegítés nélkül is olvasható lesz. Ez pedig már nem titkosírás…
Óvatosan kell dolgoznunk, mert ha nem vigyázunk, túl sokáig és túl közel tartjuk a papírt a lánghoz, akkor nem tudjuk elolvasni a levelet, mert az egész felülete megbarnul. (Legrosszabb esetben meggyullad a kezünkben a papír. Ekkor viszont elmondhatjuk a levélről, hogy tényleg titkosírással íródott: senki sem tudta elolvasni… A regény hősnőihez hasonlóan használjunk inkább vasalót.)
3.3.4. „Színház az egész világ…”
„…és színész benne minden ember…” Shakespeare valószínűleg nem gondolt bele, hogy mennyire érvényes ez a kémia világára is. Szín kavalkád, meglepő fordulatok, mérgek, drámai történések – ezek az angol író műveinek legfőbb jellemzői. Vagy egy kémiai kísérletről beszélünk? Az egyik leghíresebb Shakespeare-mű, a Rómeo és Júlia is felhasználja a kor, a XVI. század kémiai ismereteit. Hogyan ért véget a tragikus szerelem? A szülők által kitűzött, kényszerű esküvő elől menekülve Júlia – aki már titokban feleségül ment Rómeóhoz – segítséget kér Lőrinc baráttól, aki egy tetszhalott állapotot előidéző mérget ad Júliának. Az oldat hat, ám Rómeó nem tudja meg, hogy a halottnak látszó lány valójában nem halt meg, így ő bánatában megöli magát. A felébredő Júlia pedig, miután meglátja halott szerelmét, végez magával.
„Júlia
Vagy küldj a frissen-ásott sírba hálni,
Egy szemfedőbe dugva a halottal –
Mindezt, miről ha hallottam, remegtem,
Félsz nélkül e percben megteszem,
Csak édesem hű hitvese maradjak.Lőrinc
Várj, fuss haza, légy víg, egyezz bele,
Hogy Párishoz mégysz: holnap szerda van.
Intézd, hogy éjjel hálj majd egyedül,
Még a dadát se engedd a szobádba.
Fogd ez üvegcsét s hogyha ágyba fekszel,
Párolt italját idd ki hirtelen:
Álmos, hideg nedv nyargal át azonnal
Véred csatornáin: verőered
Természet-adta lüktetése megszűn:
Hő s lélegzet nem mondja már, hogy élsz,
Orcádon-szádon hamvadoz a rózsa,
Szemednek ablaka is becsukódik,
Akár halál zárná ki a verőfényt.
Minden tagod elveszté símaságát
Görcsös-feszes lesz, hűs, mint a halálé:
S kölcsön-mezében a meredt halálnak
Fekszel te így negyvenkét óra hosszat,
Majd mint üdítő álomból fölébredsz.
Hát hogyha reggel jő a vőlegényed
Felkölteni, halott gyanánt heversz ott.
Aztán – amint szokás ez városunkban –
Nyitott koporsón, ünnepi ruhádban
Elvisznek az ősrégi kriptaboltba,
Ahol Capulet-őseid nyugosznak.
Közben, mikor már-már ocsúdni készülsz,
Megtudja tervünk Romeo, levélből –
És itt terem: aztán majd ő meg én
Vigyázzuk ébredésed s aznap éjjel
Romeo Mantovába szöktet el.
Ez ment meg íme most a szégyenedtől,
Ha csélcsap ábránd, női félelem
Le nem nyűgöz és bátran is cselekszel.Júlia
Jaj, add nekem. Ne szólj a félelemről.Lőrinc
Fogd s most eredj és légy erős, szerencsés
Tettedben: én egy szerzetest menesztek,
Hogy Mantovába vinné levelem.Júlia
Ó, adj erőt, sikert, te Szerelem.
Isten veled, atyám.”
Nem minden méreg öl, és nem minden gyógyszer gyógyít. Lőrinc barát csodaoldata hatott, ám végül – mint minden Shakespeare-drámában – minden főszereplő meghalt.
A mérgekről a következő fejezetben olvashatunk.
3.4. A „kriminális” kémia
A krimi-irodalom egy kémiatanár számára mindig is hálás téma volt, és remélhetőleg az is marad. Sherlock Holmes kitűnő vegyész, Agatha Christie gyilkos érzékkel válogat a mérgek között, a megtörtént eseteket pedig képtelenség a teljesség igényével felsorolni. Barangoljunk egy kicsit a bűnügyek világában!
3.4.1. Az aranybogár
Az előző fejezet végén már volt szó a láthatatlan írásról. Edgar Allan Poe egyik novellája szintén tartalmaz egy kémiailag helyes „tintareceptet”.
„Magad is jól tudod, időtlen idők óta léteznek olyan vegyszerek, amelyek segítségével lehetséges úgy írni papírra vagy pergamenre, hogy a betűk csak hő közelében válnak láthatóvá. Ha például kék kobalt-oxidot aqua regiában oldunk fel, majd négyszer annyi vízzel hígítjuk, zöld színt kapunk. A salétromsavban oldott kobalt piros színt ad. Ezek a színek rövidebb-hosszabb szünet után láthatatlanná válnak, ha az anyag, amire írtunk, lehűl; de ha felmelegítjük, újból láthatóvá válnak.”
Poe novellájában kobaltionokat tartalmazó oldattal történik a titkos adatok, a kincs lelőhelyének leírása. A kristályvíztartalmú $\mathrm{CoCl_{2}}$ rózsaszínű kristályos anyag. (A hidratált kobalt(II)-ionok színe rózsaszín.) Hevítés hatására kristályvizét elveszíti; a hidratálatlan kobaltionokat tartalmazó kobalt-klorid kék színű.
$$\definecolor{maintext}{RGB}{51,51,51}\definecolor{baldoboz}{RGB}{255,153,204}\definecolor{jobbdoboz}{RGB}{0,153,255}\mathrm{\color{baldoboz}{\blacksquare}\color{maintext}\ \ \ \ \left[Co(H_{2}O)_{6}\right]^{2}\ \xrightarrow{\ \ hevítés\ \ }\ Co^{2+}+6\ H_{2}O\ \ \ \ \color{jobbdoboz}{\blacksquare}}$$Ha koncentrált sósavat öntünk a híg kobalt-klorid oldathoz, a kloridion koncentráció az oldatban nő, és kialakulnak a kobalt klorokomplexei, amelyek kék színűek.
$$\definecolor{maintext}{RGB}{51,51,51}\definecolor{baldoboz}{RGB}{255,153,204}\definecolor{jobbdoboz}{RGB}{0,153,255}\mathrm{\color{baldoboz}{\blacksquare}\color{maintext}\ \ \ \ \left[Co(H_{2}O)_{6}\right]^{2+} +4Cl^{–}\ \ \ ==\ \ \ \left[CoCl4\right]^{2–}+6\ H_{2}O\ \ \ \ \color{jobbdoboz}{\blacksquare}}$$A kobalt-tetrakloro-komplex stabilitási állandója elég kicsi, ezért csak koncentrált sósavval és csak viszonylag tömény kobaltsóoldatból lehet leválasztani. Hígítás hatására az egyensúly az akvakomplex képződése irányába tolódik el.
Írhatunk levelet híg $\boldsymbol{\mathrm{CuSO_{4}}}$-oldattal is. (Elegendő a nagypapa kamrájában keresni egy kis rézgálicot… Vigyázat, méreg!) A hidratált réz(II)-ionok világoskék színűek, hevítés hatására elvesztik kristályvizüket, fehérek lesznek. A megírt levélen melegítés hatására nem látszik semmi, de ha egy edénybe tömény ammónia-oldatot teszünk, ezt óvatosan melegítjük, a papírt pedig az edény fölé tartjuk, akkor rövid időn belül sötétkék színnel megjelenik az írás. Ennek az az oka, hogy az ammónia komplexet képez a rézionokkal, ennek színét látjuk a papíron.
$$\mathrm{CuSO_{4}+4\ NH_{3}=\left[{Cu({NH}_{3})}_{4}\right]SO_{4}}$$Ha nincs kéznél tömény ammónia-oldat, akkor elegendő egy kis vizet párologtatni a levélre, ekkor ha nem túlságosan híg rézszulfát-oldattal készült az írás, és elég jó a szemünk, akkor elolvashatjuk a leírt sorokat. (Figyelem! Esős időben a kíváncsi postásnak is akad egy kis olvasnivaló…)
Maradjunk a kertnél. Permetezőszer helyett káposztával is tudunk levelet olvasni. Persze, nem tehetjük az orrunkra, mint egy szemüveget. Ravaszabb módszereket kell találnunk. Ha a vöröskáposzta levelét desztillált vízben főzzük, akkor a kapott kék levet indikátorként használhatjuk: savban piros színű, semleges kémhatású oldatban kék, lúgban zöld, majd sárga lesz. Így ha híg nátrium-hidroxid oldattal írunk levelet, akkor a káposztalé hatására az írás sárgászöld színben olvasható.
A láthatatlan tinták kémiaórán való bemutatása – jellegéből adódóan – nem csak egy alkalommal kerülhet elő. A kilencedik osztályosoknál a sav-bázis reakciók tanulmányozásánál vizsgálhatjuk a káposzta indikátor jellegét; tizedik osztályban, az ecetsavról és a szőlőcukorról szóló órákon mutathatjuk be a titkosírás ezen válfaját; majd 11. osztályban a vascsoport és a rézcsoport elemeinek tárgyalásakor végezhetjük el a megfelelő kísérleteket.
3.4.2. A gyilkos kémia
Mi okozhatja a krimik, a bűnügyi történetek sikerét? Talán nem az, hogy valaki meghal. Sokkal inkább a bűnügy felderítését akadályozó események, bonyodalmak, s az, hogy a végén úgyis kiderül, hogy ki ölte meg – és főként milyen módszerrel – az áldozatot. Sokakban bizonyára fel sem merül, hogy a gyilkosságok nagy részét nem hagyományos módszerekkel, például késsel vagy pisztollyal, hanem kémiai eszközökkel követik el. A kémiatanár feladata nem az, hogy a bűntényt, mint követendő példát mutassa be a gyerekeknek, hanem az, hogy megkeresse a kémiai vonatkozásokat egyes vegyületek, reakciók esetén. És persze a gyerekeknek sem árt meg, ha nem csak a televíziót bámulják, hanem néha könyvet is vesznek a kezükbe.
3.4.3. Agatha Christie és a mérgek
A krimiolvasók népes táborában nagyon is ismerősen cseng Agatha Christie neve. Az írónő gyógyszerek és mérgek sokaságát szerepeltette regényeiben és elbeszéléseiben, ám valószínűleg kevesen tudják róla, hogy az első világháború idején, mint önkéntes ápolónő, gyógyszerelosztó képesítést szerzett, majd élete második felében, több mint ötvenévesen megújította gyógyszerészeti ismereteit, amikor egy londoni kórház gyógyszerkiadójában dolgozott.
Agatha Christie viszonylag rövid ideig járt iskolába, még kevesebbet tanult oklevele megszerzéséig. Mégis, első regényéről – The Mysterious Affair at Styles (1920) – mind a krimi irodalom, mind a gyógyszerészeti szaklapok elismerően írtak; utóbbiak azért, mert az írónő a cselekményben halált okozó méreg és egy gyógyszer összeférhetetlenségét írta le.
Műveiben több mint száz különböző gyógyszert, vegyszert, kábítószert, mérget „dolgozott fel”. Nézzünk meg néhányat!
Agatha Christie legismertebb – és talán legnépszerűbb – regénye a Tíz kicsi néger. Kémiatanárok és érdeklődő gyerekek számára tökéletes forrás ismeretlen és érdekes vegyületek és hatásaik megismerésére. (Kipróbálni szigorúan tilos!)
„[…] Vera fölkelt. Odament a toalettasztalhoz és bevett három aszpirint.
»Bárcsak volna valami altatóm!« – gondolta.
Aztán: »Ha én akarnék végezni magammal, veronált vennék be, vagy valami hasonlót, nem ciánkálit.«
Megborzongott, amikor eszébe jutott Anthony Marston eltorzult, szederjes arca.
Lombard folytatta:
– Vagyis ha elfogadjuk azt az állítást, hogy Rogersék annak idején gyilkosságot követtek el, és nem leplezték le őket. És nem látom semmi okát, miért ne tehették volna. Mit gondol, hogy csinálhatták? Megmérgezték az öreg hölgyet?
Armstrong halkan azt mondta:
– Egyszerűbben is megtörténhetett. Megkérdeztem Rogerstől ma reggel, mi baja volt Miss Bradynek. A válaszából sok mindenre fény derült. Nem akarok részletes orvosi magyarázatokba bocsátkozni, tény az, hogy a szívbajosoknál bizonyos esetekben amylnitritet alkalmaznak. Ha jön a roham, feltörnek egy fiola amylnitritet, és a beteg belélegzi. Ha az amylnitritet megtagadják a betegtől, nos, a következmények végzetesek lehetnek… Tulajdonképpen nem kell semmit se csinálni. Nem kell arzént szerezni, és beadni… egyszerűen csak meg kell tagadni az orvosságot! És Rogers éjnek idején elrohant, hogy orvost keressen, vagyis meg voltak győződve róla, hogy soha senki se jön rá a dologra.
Blore kicsit zavarba jött. Téglavörös arca még vörösebb lett egy árnyalattal. Amikor megszólalt, valósággal kirobbantak belőle a szavak:
– Ide figyeljen, doktor, maga adott neki valami kábítószert.
Armstrong rámeredt.
– Kábítószert? Hogy érti ezt?
– Az este. Hiszen maga mondta, hogy adott neki valamit, hogy elaludjon.
– Ja igen, persze. Ártalmatlan nyugtatót.
– Egészen pontosan mit?
– Egy kis adag trionált. Teljesen ártalmatlan készítmény.
Blore még jobba elvörösödött.
– Ide figyeljen… ne kerteljünk… nem adott neki túl nagy adagot?
– Öten vagyunk ebben a szobában. Ötünk közül valaki gyilkos. A helyzet rendkívül veszélyes. Mindent el kell követnünk, hogy a négy ártatlan életet megmentsük. Szeretném megkérdezni, dr. Armstrong, milyen gyógyszerek vannak a birtokában?
– Van egy kis gyógyszeres dobozom – felelte Armstrong. – Megnézheti. Talál benne egy kevés altatót, trionál- és szulfonáltablettákat, egy csomag brómot, szódabikarbónát meg aszpirint. Mást nem. Ciánom nincs.
– Nálam is van néhány tabletta altató – mondta a bíró. – Azt hiszem, szulfonál. Valószínű, hogy a szulfonál is lehet halálos, ha elegendő mennyiséget adnak be valakinek belőle.
Ciánkálihoz minden háztulajdonos könnyen hozzájuthat: rovarirtónak használják… Betegségem utolsó szakaszában felírtak valami altatót – klorálhidrátot. Könnyű volt annyit eldugnom, hogy végül is halálos adag volt a birtokomban. Amikor Rogers konyakot hozott a feleségének, letette az asztalra, én meg az asztal mellett elhaladva belecsempésztem a mérget a konyakba… Reggeli közben becsempésztem maradék klorálomat Miss Brent kávéjába, amikor újratöltöttem csészéjét. Aztán magára hagytuk az ebédlőben. Valamivel később beosontam – a nő majdnem eszméletlen volt, könnyen bele tudtam fecskendezni egy adag erős ciánkáli oldatot. Az a méh-dolog alapjában véve gyerekes volt egy kicsit – de tudj’ isten, valahogy tetszett nekem… Rögtön ezután megtörtént, amire számítottam – azaz – hogy azt hiszem, tulajdonképpen magam javasoltam. Szigorú motozásnak vetettük alá magunkat. A revolvert addigra már biztos helyre eldugtam, és se ciánkálim, se klorálom nem volt már…”
Az idézetben előforduló legfontosabb gyógyszerek és mérgek: a klorál, a ciánkáli, az aszpirin, a veronál, az amylnitrit, a trionál, a szulfonál, a bróm és a szódabikarbóna. Nézzük meg ezeket az anyagokat közelebbről.
A klorál (triklór-acetaldehid) acetaldehidből klórozással állítható elő.

Fontos szerepe van a DDT – 1,1-bisz(4-klór-fenil)-2,2,2-triklór-etán – szintézisében, amely színtelen, szagtalan, vízben oldhatatlan, de olajokban és több szerves oldószerben jól oldódó kristályos vegyület.
A legjobb rovarölő szerek egyike, amelyet világszerte használtak például szúnyogirtásra – és ezáltal a malária leküzdésére. Kis mennyiségben az emberre veszélytelen, halálos adagja 10–30 g között van. Kiderült azonban, hogy nagy élettartamú, stabilis vegyület, amely felhalmozódik az állati és az emberi zsírszövetben; gyakori alkalmazása hatására pedig megnő a rovarok ellenállása a szerrel szemben. (Az utóbbi évtizedekben használatát korlátozták.)

Oxidációjával triklór-ecetsav állítható elő, amely színtelen levegőn elfolyósodó kristályokat képez, vízben, alkoholban jól oldódik. Felhasználható fehérjék kicsapására, gyógyászatban szemölcsök és tyúkszemek lemaratására.
$$\mathrm{CCl_{3}–CHO\xrightarrow{\ \ ox.\ HNO_{3}\ \ }CCL_{3}–COOH}$$A klorálhidrát (triklóraldehidhidrát) klorál vízben való oldásakor keletkezik.
Színtelen kristályos vegyület, vízben, alkoholban és éterben egyaránt jól oldódik. A legrégebbi szintetikus altatószer; 1–2 grammja már 10–15 perc alatt álmosságot okoz, amely többórás mély álomba mehet át.
A cián, vagy ciánkáli szintén régóta ismert méreg. (Napjaik szomorú aktualitása a Tiszába ömlött és a halállomány nagy részét elpusztító ciántartalmú anyag, hogy a nehézfémsók hatásáról ne is beszéljünk.) A ciánkáli néven ismert méreg két vegyületet jelent: a hidrogén-cianidot és annak káliumsóját, a kálium-cianidot.
A hidrogén-cianid (HCN) folyékony, vízzel és alkohollal jól elegyedő vegyület. Folyékony vagy gőzállapotban mérgező, halálos adagja 60 mg. Kisebb mennyiségben légszomjat, majd görcsöket okoz, ugyanis hatástalanítja a légzőenzimekben lévő létfontosságú vasat. Cianidmérgezés után a beteggel kámfort kell lélegeztetni, esetleg 3%-os hidrogén-peroxid vagy 0,1%-os kálium-permanganát oldatot kell itatni. Gyorsan ölő méreg. Fontos megjegyezni azt, hogy egyes növényekben, például a cseresznyefélékben, a kukoricacsutkában, a szénában nagy mennyiség tud felgyülemleni: a növények nagymennyiségű, ciántartalmú szénhidrátokat, ún. ciano-glikozidokat építenek fel, amelyek megfelelő enzimek hatására hidrogén-cianiddá alakulnak.
A kálium-cianid (KCN) fehér kristályos vegyület. Minden savval – közöttük a gyomor sósavtartalmával is – reagál, hidrogén-cianid keletkezése mellett. Rendkívül mérgező, már 0,15 g halált okoz.
$$\mathrm{KCN+HCl=KCl+HCN}$$Az aszpirin (acetil-szalicilsav) jó fájdalom- és lázcsillapító. Az egyik legtöbbet használt gyógyszer. Szalicilsav és ecetsavanhidrid reakciójából keletkezik.
A szalicilsav – 2-hidroxi-benzoesav – színtelen, szagtalan, könnyen szublimáló, vízben rosszul, etanolban, éterben jól oldódó vegyület. Baktériumölő hatású, enyhíti a reumatikus fájdalmakat. Megtalálható a kamilla virágában, de egyes fák, például a fűzfa és a nyárfa kérgében is. Már az ókori ázsiaiak is használták gyógyításra a fűzfakéreg kivonatát, ám a szalicilsav és módosulatainak általános használata csak a múlt század végén terjedt el. A betegeket kezdetben szalicilsavval kezelték, ám a vegyület irritálta a szájüreget, a nyelőcsövet és a gyomrot; majd kipróbálták nátriumsóját is, amely már nem volt irritáló hatású, de borzalmas íze volt, nagyobb dózisokban hányást váltott ki. A megoldást a szalicilsav acetilezése jelentette: a kapott vegyület megfelelőnek bizonyult, s az íze is leviselhető volt. Manapság az aszpirint nemcsak fájdalom- és lázcsillapítóként, hanem a szívbetegségek következményeinek kezelésében is használják.
A veronál (5,5-dietil-barbitursav) színtelen, szagtalan keserű kristályos vegyület, a barbitursav szubsztituált származéka. Nyugtató és altató hatású, ám huzamosabb ideig való szedés esetén megszokás lép fel. Felhasználható még skizofrénia és mániákus depresszió gyógyítására. Előállítása – hasonlóan a barbitursav szintéziséhez – malonészter (pontosabban annak egy szubsztituált származéka) és karbamid segítségével történik.

Az amylnitrit (salétromsavas amilészter) sárgás színű, csípős ízű folyadék. Vízzel nem elegyedik, alkoholban és éterben jól oldódik. Belélegezve kitágítja a véredényeket, így vérnyomáscsökkentő hatású. Átmenetileg használható asztma, epilepszia, fejfájás, tehát olyan betegségek esetén, amelyek kísérő tünete a fej, az agy csökkent vérellátása.
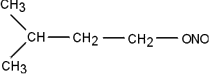
Gyógyszerészeti jelentősége a bróm helyett káliumsójának, a kálium-bromidnak van: csökkenti a központi idegrendszer ingerlékenységét. Már a múlt század közepén használták nyugtató- és görcsoldó szerként például az epilepszia kezelésében.
A szulfonál (dietil-szulfondimetil-metán) színtelen, szagtalan kristályos vegyület; vízben rosszul, alkoholban és éterben jól oldódik. Altatószerként használták.
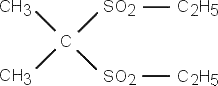
A trionál (dietil-szulfoetiletil-metán) színtelen, kristályos anyag, amely vízben rosszul, éterben és alkoholban jól oldódik. A szulfonálhoz hasonló tulajdonságokkal rendelkezik, de kevésbé mérgező. Altatószerként használják.
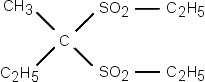
A szódabikarbóna (nátrium-hidrogén-karbonát) fehér színű por. Bevéve ártalmatlan, viszont gyomorsavtúltengés esetén sikerrel alkalmazható.
$$\mathrm{NaHCO_{3}+HCl=NaCl+H_{2}O+CO_{2}\ \uparrow}$$Az írónő egy másik regénye más jellegű gyilkossági kísérletet dolgoz fel. A Bűbájos gyilkosok nem egy hagyományos ciánkálit vagy arzént felhasználó bűncselekményről – vagy bűncselekmény-sorozatról – szól, hanem egy egészen különleges esetet tárgyal.
„– Micsodát?
– Azt, mi feltűnt nekem. Valami olyasmit mondott: »Szegény jó asszonyom, hogy mennyit szenvedett. Az a szörnyű daganat az agyában, pedig előtte maga volt az egészség. Olyan szomorú volt látni a szanatóriumban, ahogy a haja, az a szép, sűrű, ősz haja, amit kéthetenként rendszeresen kikékíttetett, mind a párnájára hullott. Marokszámra hullt ki.« És akkor, Mark, a barátnőm, Mary Delafontaine jutott eszembe. Az ő haja is kihullott. És eszembe jutott, hogy maga mesélt egy lányról, akit Chelsea-ben látott egy kávézóban, és akinek egy másik lány tövestül tépte ki a haját. Pedig tudja, Mark, a hajat nem könnyű kitépni. Csak próbálja ki, próbáljon kitépni pár szálat a saját hajából! Próbálja meg! Majd meglátja! Higgye el, Mark, nem természetes, hogy ezeknek az embereknek tövestül hullt ki a hajuk. Valami újfajta betegség lehet, bizonyára jelent valamit…
Lecsaptam a kagylót, majd ismét felemeltem. Tárcsáztam, és szerencsémre ezúttal Lejeune jelentkezett.
– Mondja – kérdeztem –, Gingernek mostanában hullik a haja?
– Nos, azt hiszem… igen. A magas láztól, gondolom.
– Egy frászt – mondtam. – Gingernek ugyanaz a baja, mint eddig mindenkinek. Tallium-mérgezés. Egek ura, add, hogy ne legyen még késő!
– Miről jutott eszébe a tallium?
– Hirtelen minden összeállt. Az egész azzal kezdődött, amit egy estén Chelsea-ben láttam. Egy lány tövestől tépte ki a másik lány haját. És az első lány azt mondta: »Nem is fájt.« Nem hősködésből mondta, ahogy akkor gondoltam, hanem egyszerűen ez volt a tény. Nem fájt. Amikor Amerikában jártam, olvastam egy cikket a talliummérgezésről. Egy gyárban egymás után meghalt sok munkás. Roppant változatos betegségekben. Ha jól emlékszem, többek között paratífuszban, szélütésben, agybénulásban, epilepsziában, bél- és gyomorhurutban. Másutt kiderült, hogy egy nő hét embert megmérgezett. A diagnózisok között szerepelt agytumor, agyvelőgyulladás és tüdőgyulladás. Vagyis, ha jól értem, a tünetek nagyon eltérőek lehetnek. Némelyik esetben hasmenéssel és hányással kezdődik, máskor kábultsággal, végtagi fájdalmakkal, és a diagnózis heveny ideggyulladás, reumás láz vagy paralízis. Egyik beteg vastüdőbe került. Esetenként még a bőr is elszíneződik.
– Maga egy két lábon járó orvosi szótár.
– Nem csoda. Ugyanis átlapoztam. De van valami, ami előbb vagy utóbb mindig bekövetkezik. A hajhullás. Egykor a talliumot szőrtelenítésre használták, különösen gyerekeknél, ótvar ellen. Majd kiderült, hogy veszélyes. Néha belsőleg is használják, de nagyon óvatosan, a beteg testsúlyának megfelelő adagokban. Manapság, ha jól tudom, főként patkányméreg. Ízetlen, vízben jól oldódó, és könnyen hozzá lehet jutni. És van még egy előnye: nem lehet mérgezésre következtetni belőle…”
A tallium és vegyületei lenyelve, vagy akár a bőrrel érintkezve egyaránt rendkívül mérgezőek; az oldható tallium-vegyületek megengedett maximális koncentrációja a levegőben 0,1 mg/m3. A $\mathrm{Tl_{2}SO_{4}}$-t korábban elterjedten használták rágcsáló- és hangyairtó szerként, de ezt az íztelen és szagtalan anyagot sok helyen veszélyesnek minősítették és betiltották alkalmazását.
Érdemes megjegyezni, hogy a tallium a periódusos rendszerben két ugyancsak mérgező nehézfém, a higany és az ólom között foglal helyet. Mit tudunk ezekről a fémekről?
Az ólom bizonyos enzimek oxocsoportjaihoz kapcsolódik, ezáltal a hemszintézis és a porfirin metabolizmus szinte minden lépését károsan befolyásolja. Az ólommérgezés jellemző tünetei a vérszegénység, fejfájás, krónikus vesegyulladás, agysorvadás és központi idegrendszeri zavarok. A kezelés az ólom komplexbe vitelével, majd annak eltávolításával történhet.
A higany – mivel folyadék és számottevő a gőznyomása – maga is toxikus. Fejfájást, remegést, emlékezetvesztést okozhat. Viszont fontos különbséget tenni a különböző Hg-vegyületek között. A Hg(I)-ionokat tartalmazó vegyületek vízben nem oldódnak, ellentétben a Hg(II)-ionokat tartalmazó vegyületek nagy részével, így a szervezetbe kerülve az előbbieknek nincs, az utóbbiaknak annál nagyobb a mérgező hatásuk.
Hasonlóan mérgező elem a kadmium, amely a fehérjék cisztein SH-csoportjaihoz kapcsolódva gátolja azok működését.
Még nem esett szó a talán legismertebb (leghírhedtebb?) mérgekről, az arzénról és a sztrichninről.
Az arzén néven elhíresült mérgező vegyület tulajdonképpen arzén-trioxid. Évszázadok óta használt méreg. Még a század elején is volt arra példa, hogy asszonyok arzén segítségével próbáltak megszabadulni öreg, beteg anyósuktól, vagy részeges férjüktől. A fehér, íztelen, szagtalan port beleszórták az ételbe, kezdetben kis adagokban, majd fokozatosan növelve a mennyiséget, hogy ne feltűnően gyorsan következzen be a kívánt halál.
Lassú, súlyos betegségre utaló, vagy gyors halál; bárhogy is történt, az arzénmérgezést az elhunyt szervezetéből (gyomor, máj, csont, hajszálak) ki lehetett mutatni.
Az arzén-trioxidot savban oldva és fémcinkkel redukálva arzén-hidrogént kapunk, amely egy jellegzetesen fokhagymaszagú vegyület. Ha az arzén-hidrogént hevítik, arzénre (arzén-tükör) és hidrogénre esik szét. (Megjegyzés: az antimon is hasonlóan viselkedik, ám ha az arzéntükör feloldása után a kapott arzénsavhoz ammóniás ezüst-nitrát oldatot adunk, sárga csapadékot kapunk, míg az antimon esetén nincs reakció.)
A sztrichnin főként Agatha Christie regényeiből ismert erős méreg. Növényi eredetű alkaloid, egy Távol-Keleten előforduló növény, a Strychnos nux vomica magjából és kérgéből izolálták.
A vegyület nagyon keserű, már nagyon kis koncentrációban (1,3 pm) íze alapján felismerhető. A sztrichnin a gerincvelőt támadja meg; a reflexeket fokozott mértékben ingerli, ez pedig az egész testre kiható izomrángáshoz, majd izomgörcshöz vezet. Nagyon gyors méreg: 32 mg-ja már 20 perc alatt halált okoz.
Agatha Christie regényei tehát nem csak fordulatokban, hanem mérgekben is gazdagok, ám a mérgező anyagok közül csak nagyon kevés része a középiskolás tananyagnak. A vegyületek, bár nem kerülnek tárgyalásra a 10. osztályos szerves kémia tanításakor, megemlíthetők a heteroatomokat tartalmazó szénvegyületek bevezetésekor. A mérgező fémek a 11. osztályban, a szervetlen kémia tárgyalásánál kerülnek elő, de mindenképp meg kell jegyezni, hogy melyik fém miért és milyen formában veszélyes. Kipróbálni őket szigorúan tilos!
3.4.4. A detektívek gyöngye: az analízis
Még a világ legjobb és leghíresebb detektívjei sem tudják ránézésre megállapítani, hogy a gyilkos milyen eszközökkel végzett az áldozatával, még inkább nem akkor, ha a halált gyógyszerek vagy mérgek okozták. Sherlock Holmes is szívesen kísérletezett, és ezen tevékenységének eredményét sokszor használta fel egy-egy bűnügy felderítésére.
„Holmes a kis asztalnál ült házikabátban, valami vegytani kísérletet végzett. A kékes fényű Bunsen-lámpa fölött vadul fortyogott valami a nagy retortában, a lepárolt cseppek egy kétliteres mérőedényben gyűltek össze. A barátom alig nézett rám, amikor beléptem, és én, látva, hogy a kísérlet fontos, egy karosszékbe telepedtem, és vártam. Holmes néhány csepp vegyszert szippantott fel különböző üvegekből a pipettájával, és a végén egy oldatot tartalmazó kémcsővel állt meg az asztal mellett. Jobb kezében egy darabka lakmuszpapírt szorongatott.
– Sorsdöntő pillanatra érkezett, Watson – mondta. – Ha a papír kék marad, minden rendben van. Ha pirosra változik, egy ember eljátszotta az életét.
Beletette a papírt a kémcsőbe. Nyomban piszkos-vörösre változott a színe.”
Úgy tűnik, hogy már Sherlock Holmes is tudta, hogy vannak olyan anyagok, amelyek másként viselkednek, különböző színűek savas és lúgos oldatokban. Azok a vegyületek, amelyeknek disszociációját színváltozás kíséri, sav-bázis indikátorként jól használhatók. (Ezek az anyagok általában gyenge savak vagy bázisok.)
A lakmusz egy zuzmóféle festékanyaga, az egyik legrégebben használt indikátor. Savas közegben piros, lúgoldatban kék színű, pH intervalluma: 6–8.
Azt nem lehet tudni, hogy a történetben ki és miért „játszotta el az életét”, de bizonyosan jobban járt volna, ha az indikátor lúgos kémhatást mutat – a kémcsőben savoldat volt…
A neves német jogtudós, Maximilian Jacta Híres angol–amerikai bűnperek című művében valóságos, megtörtént eseteket dolgoz fel. A gyilkosságok vagy más bűncselekmények felderítésében kiemelt szerepet játszik a kémiai analízis, legyen szó a halott személyazonosságának felderítéséről, a halál okának megállapításáról, vagy akár arról, hogy a nagy értékre biztosított üzemben keletkezett tűz baleset vagy szándékos gyújtogatás eredménye volt. Milyen vizsgálatokról lehet szó?
„1895 márciusában George Dean 27 éves sydneyi tengerész ellen azt a vádat emelték, hogy meg akarta mérgezni nála három évvel fiatalabb feleségét. A vád magának a fiatalasszonynak, valamint anyjának, bizonyos Mrs. Seymournak a tanúvallomásán alapult […]
A két asszony vallomása szerint Dean öt különböző alkalommal próbálta megmérgezni feleségét: négyszer élelmiszerek (húslevesek, zabkása, citromszörp és tea) felhasználásával, egyszer valamilyen porral, amelyet egy orvos írt fel neki…
A gyanúsnak tartott citromszörpöt az anya és lánya annak idején odaadták analízisre egy vegyésznek. Az oly sok arzént és sztrichnint talált benne, amennyivel egy tucat embert meg lehetett volna ölni. A fiatalasszony azt állította, hogy életét minden alkalommal csak azért sikerült megmentenie, mert valamennyi szóban forgó étel olyan keserű és undorító volt, hogy alig tudott enni belőlük. De még így is annyi méreg jutott a szervezetébe, hogy megbetegedett tőle. Ezeknél a megbetegedéseknél az arzén- és a sztrichninmérgezésnél ismert tünetek léptek fel, nevezetesen heves hányinger és hasmenés. Vegyelemzéssel megállapították, hogy ezekből a mérgekből tekintélyes mennyiség került a szervezetébe, majd eltávozott belőle…”
A kémiai analízis nem csupán a felsorolt esetekben lehet fontos, hanem ott is, ami mindenki számára teljesen nyilvánvalónak tűnik, de senkinek nem jut az eszébe: ez a terület az ujjlenyomatok vizsgálata.
Az ujjlenyomat, az ujjon lévő bőrrajzolat, hasonlóan a DNS-hez, minden embernél egyedi, és általában az ember haláláig változatlan marad. A hátrahagyott ujjnyom a testből kiválasztott anyagok és a környezetből származó szennyezések keverékéből áll. Érdekesség, hogy a gyermekek ujjlenyomata hamarabb eltűnik, mint a felnőtteké. Miért? A felnőttek ujjnyomai jóval nagyobb mennyiségben tartalmaznak hosszú szénláncú telített észtereket, ezzel szemben a gyerekek ujjlenyomata kisebb molekulatömegű, illékonyabb szerves anyagokban gazdag. Ezek a vegyületek, különösen ha sima felületre kerülnek, idővel elpárolognak, tehát az ujjlenyomat eltűnik.
Milyen módszerekkel található meg és vizsgálható az ujjlenyomat?
8. KÍSÉRLET
Előhívás jódszemcsével
Szükséges anyagok: csapzsír, jód.
Eszközök: szűrőpapír, főzőpohár.
Végrehajtás: Készítsünk ujjlenyomatot szűrőpapírra. Az ujjlenyomatot tartalmazó papír mellett helyezzünk el egy jódszemcsét, majd a főzőpohárral (lehetőleg) légmentesen zárjuk el. Az ujjnyomat néhány perc múlva barna színnel láthatóvá válik.
Magyarázat: A jód szublimálásakor keletkező jódgőzt az ujjnyomban található olaj- és zsírszerű anyagok elnyelik, az ujjlenyomat barnásvörös színű lesz. Ez az eljárás 3–5 napnál nem régebbi ujjlenyomatok előhívására alkalmas.
Ezüst-nitrát alkalmazása. Az ezüst-nitrát reagál a latens (rejtett) ujjnyomokban levő, a verejtékből származó kloridionokkal. Fényérzékeny ezüst-klorid keletkezik, amely fény (mesterséges vagy napfény) hatására elbomlik, fémezüst keletkezik, és így megjelenik a lenyomat fekete képe. A módszer egy hétnél régebbi nyomok előhívására nem alkalmas.
$\mathrm{AgNO_{3}+NaCl\ \rightarrow\ AgCl+NaNO_{3}}$
fény
$\mathrm{AgCl\ \rightarrow\ Ag+0,5\ Cl_{2}}$
Ninhidrin (1,2,3-indántrion-hidrát). Színtelen, kristályos vegyület.

A ninhidrin és az aminosavak reakciójának eredményeként egy ibolyásvörös színű (ún. Ruhemann-bíbor) anyag keletkezik, amely egyes fémsó oldatokkal (cink- vagy kadmiumionokat tartalmazó oldatokkal) fluoreszcens termékeket képez.
Akár 30 éves ujjlenyomatok esetén is használható módszer.
Proteinfestékek alkalmazása. Véres ujjlenyomatok vizsgálatára alkalmas; a proteinfestékek segítségével a vérnyom eltávolítás, lemosás után is, akár egymilliószoros hígításban is kimutatható.
Az amidofekete proteinfesték porózus és nem porózus felületeken egyaránt alkalmazható, az ujjnyomok kékesfekete vonalakként láthatók.
A coomassie kék használata esetén az ujjlenyomat halványkék.
A kémiai analízis tágabb értelemben az egész középiskolai és az azt követő kémiát jelenti, viszont most meg kell elégednünk bizonyos anyagrészek kiemelésével, ahová az előbb felsorolt vizsgálati módszereinket beilleszthetjük. 9. osztályban, a protolitikus reakciók tárgyalásánál beszélhetünk Sherlock Holmes vizsgálati módszereiről; egy évvel később, az oxigéntartalmú szerves vegyületek között megemlíthetjük a ninhidrint és bűnügyi vonatkozásait; majd 11. osztályban a halogéneknél és a d-mező elemeinek vegyületeinél ismét előkerülhet a kémiai bűnüldözés, az ujjlenyomatok vizsgálata.
Kábítószerek
„Az asszony reggel hétkor ébredt fel, és látta, hogy az ura még nem tért haza. Gyorsan felöltözött, szólt a szolgálónak, és kettesben lementek az istállóhoz. Az ajtó nyitva volt, Hunter elkábítva aludt egy székben, a híres ló rekesze üres, és az idomárnak se híre, se hamva.
Gyorsan felverték a lószerszámkamra fölötti szecskavágó padláson alvó lovászfiúkat. Semmit sem hallottak az éjszaka, mélyen aludtak. Hunter szemmel láthatólag valami erős altatószer hatása alatt volt, és mivel nem tudták magához téríteni, békén hagyták, hadd aludja ki magát […]
[…] Hunter is magához tért a kábulatból, ő is felismerte a kendőt. Biztos volt benne, hogy az idegen szórta az ablakon keresztül az altatót a currys ürühúsra – ezzel kábította el az istálló őrét…
A vegyvizsgálat kiderítette, hogy az istállóban levő lovászfiú vacsorájának maradványaiban sok ópiumpor volt, pedig ugyanezt az ételt ették a többiek is vacsorára a házban, minden kellemetlen következmény nélkül…
Holmes a fejét rázta.
– Egy ügyes ügyvéd darabokra szaggathatja az egészet. Miért vitte el a lovat az istállóból? Ha meg akarta sebesíteni, ott is megtehette volna. Volt-e kulcsa az istállóhoz? Melyik gyógyszerész adta el neki az ópiumport? És végül, hol rejthet el valaki, aki nem is ismerős ezen a vidéken, egy lovat, méghozzá éppen ezt a lovat? Mit mond, milyen papír volt a kezében, mit akart a szolgálóval a fiúnak eljuttatni?
Állítása szerint egy tízfontos bankjegy. Akadt egy tízfontos a tárcájában. De a többi ellenvetés nem ilyen hatásos. Ismerős ezen a vidéken, nyáron kétszer is megszállt Tavistockban. Az ópiumport valószínűleg Londonból hozta. A kulcsot később bizonyára eldobta. A ló pedig valamelyik dartmoori homokbánya vagy téglavető mélyén lehet…
A pullmankocsi sarkába húzódtunk a London felé száguldó vonaton, és soha ilyen rövidnek nem tetszett az utazás Ross ezredesnek és jómagamnak, mint most, hogy Holmes beszámolóját hallgattuk arról, mi történt tulajdonképpen a dartmoori istálló közelében múlt hétfő éjjel, és miképp derítette ki az igazságot.
– Be kell vallanom – mondta –, hogy teljesen téves elképzeléseim voltak az újságcikkek alapján. Pedig a cikkekben a fontos tények is benne voltak, de a lényegtelen részek teljesen elborították őket. Azzal a meggyőződéssel mentem le Devonshire-ba, hogy Fitzroy Simpson a bűnös, bár tudtam, hogy az ellene szóló bizonyítékok még hiányosak. Csak a hintóban láttam át, mikor az idomár házához értünk, hogy miért fontos a currys ürühús. Talán emlékeznek rá, hogy szórakozottan ültem a kocsiban, mikor maguk leszálltak. Azon csodálkoztam, hogyan is kerülhette el a figyelmemet egy ilyen nyilvánvaló nyom.
– Nekem meg azt kell bevallanom – mondta az ezredes –, hogy nem tudom, mi jelentősége van a currys húsnak.
– Ez volt az első láncszem a gondolatmenetemben. Az ópiumpor nem íztelen. Nem kellemetlen az íze, de észrevehető. Ha valamilyen megszokott ételbe keverik, nyomban megérezné az, aki megkóstolja az ételt, és nem enne belőle. A curry a legalkalmasabb fűszer ennek az íznek az elnyomására. De Fitzroy Simpson, az idegen, semmiképp nem tudhatta, hogy currys húst fognak főzni aznap az idomár házában, és túlzottan merész feltételezés volna arra gondolni, hogy véletlenül éppen ópiumpor volt nála, amikor az ópium íz elfojtására alkalmas ételt szolgáltak fel. Ez elképzelhetetlen. Simpsonnal tehát nem kellett tovább foglalkoznom, figyelmemet Strakerre és a feleségére összpontosíthattam, hiszen ők választhatták aznap vacsorára a currys ürühúst. Az ópiumport akkor keverték bele a fiú ételébe, amikor külön tányérban volt már, mert a többieknek kutya bajuk sem lett a vacsorától. Kinek volt tehát módja észrevétlenül ópiumport keverni az ételbe? De még nem is válaszoltam erre a kérdésre, mikor eszembe jutott, milyen fontos láncszem az is, hogy a kutya nem ugatott aznap éjjel…”
A krimi irodalomban és a bűntényekben nem csak a mérgek, hanem a különböző kábítószerek is fontos szerepet játszanak. A legismertebb és legelterjedtebb természetes eredetű drogok a hasis, a heroin, az ópium és a kokain.
A hasis az indiai kender (Cannabis Sativa variacio indica) virágából nyert, semmilyen vegyi változásnak alá nem vetett gyanta. Hatóanyaga a dibenopiránvázas tetrahidro-cannabinol. (Megjegyzés: a Magyarországon is megtalálható vadkender csak nyomokban tartalmazza a hatóanyagot.) Fájdalomcsillapító hatású szer, nagyobb adag fogyasztása esetén hallucináció, szorongás, tartós fogyasztásnál depresszió, gondolkodási zavar, pánikhangulat lép fel.
A kokaint, pontosabban a kokacserje (Erythroxyloncoca) leveleinek hatóanyagát már egyes indián törzsek, többek között az inkák is ismerték. Tropánalkaloid: benzoesav-metilekgonin.
Erős helyi érzéstelenítő, tartós fogyasztása hallucinációkat, skizofréniás tüneteket, nagyobb adagja légzésbénulást, így halált okozhat.
Az ópium évezredek óta ismert, mint kábítószer. A mák (Papaver somniferum) éretlen gubójából kinyert anyag több alkaloidnak és különféle kísérő anyagoknak a keveréke. Ezek között legnagyobb mennyiségben (kb. 10%-ban) a morfin található
A morfin két hidroxilcsoportjának acetilezésével előállítható a heroin. A heroin a legveszélyesebb kábítószer, mert a függőség akár néhány alkalommal történő használat után is kialakulhat. Túladagolása légzésbénulást, így halált okoz.
Az ópiumszármazékok erős fájdalomcsillapító hatásúak, csökkentik a légzésközpont érzékenységét, azonban csak súlyos betegek számára adhatók, ugyanis a sejtek anyagcsere-folyamataiba beépülve nélkülözhetetlenné válnak.
Néhány évvel ezelőtt még a műanyagszatyrokba töltött Technokol ragasztó (és benne a toluol) jelentette a legfontosabb és mindenki által elérhető kábítószert. Napjainkra a helyzet szinte teljesen megváltozott. A fejezetben felsorolt anyagokon kívül egyre több újabb vegyület, újabb veszélyforrás keletkezik; ezek pedig felbecsülhetetlen károkat okozhatnak.
Örvendetes jelenség, hogy a diákok túlnyomó része érdeklődést mutat a kábítószerekkel kapcsolatban tartott felvilágosító előadások iránt. Sajnos, az órák anyagába való beépítésre a tananyag feszített üteme nem ad lehetőséget (esetleg 10. osztályban a heteroatomokat tartalmazó szénvegyületek tárgyalásánál); ám úgy vélem, hogy a cél érdekében tanévenként legalább egyszer 45 percet rászánhatunk arra, hogy megpróbáljuk megóvni tanulóink egészségét, biztonságát, életét.
3.4.5. Sötétségben a fény
Van még valami, ami nem kötődik szorosan a krimikhez, de a gyerekek fantáziáját mindig megmozgatja. Miért van az, hogy egyes tárgyak furcsa fényt bocsátanak ki magukból, és ha világítanak, akkor ez miért csak sötétben látszik? Úgy látszik, több íróra is nagy hatással volt ez a hétköznapinak egyáltalán nem mondható „csoda”.
„Amit pedig megpillantottam, egy kutya volt, egy irdatlan, koromfekete eb, amilyet azonban eddig nem láthatott földi szem. Szája tüzet okádott, szeme lánggal égett, pofája, farka, lábai vészjóslóan sziporkáztak. Meghibbant agyvelő sem találhatott volna ki vadabb, ijesztőbb, pokolibb monstrumot, mint amilyen ez az ördögi formájú, vad ábrázatú lény volt, s amely oly hirtelen penderedett elő a ködfelhő belsejéből…
Csupán nagyságát és erejét tekintve is ijesztő volt ez a lény, amely most itt hevert lábunk előtt. Nem véreb volt, és nem is szelindek, hanem inkább e kettő keveréke. Ösztövér volt, és elvadult, csaknem akkora, mint egy kisebb fajta oroszlán. Még most, halottan is szinte lángolt a szája, kicsiny, mélyen ülő, kegyetlen szemei tűzben égtek. Ahogy azonban megérintettem sziporkázó pofáját, s aztán megnéztem a kezemet, ujjaim felragyogtak a sötétben.
– Foszfor – kiáltottam fel.
– Méghozzá nagyon ravasz készítmény – toldotta meg Holmes, miután megszagolta a dögöt. – Nincs semmi szaga, tehát nem is zavarhatta meg az állat szimatát.
Miután a levél elment, vitát provokált, amelynek során lebeszélte a nőt a találkozóról, s így végre itt volt a várva várt alkalom.
Stapleton még azon este kocsiba ült, hogy hazamenjen Coombe Tracey-ből. Sok ideje nem maradt. Előhozta a kutyát, bekente a foszforeszkáló folyadékkal, majd az ily módon előkészített állatot a kapu közelébe vitte, ahol előbb-utóbb meg kellett jelennie az öregúrnak.
A kutyát addig ingerelte, míg át nem ugrott a kerítésen, és űzőbe nem vette a szerencsétlen baronetet, aki sikoltva menekült előle a tiszafa-alléba. Ebben a sötét alagútban a lángoló pofájú, parázsló szemű óriási, fekete állat valóban rettenetes látványt nyújthatott, ahogy nagy ugrásokkal egyre csak közeledett… Nem csoda, hogy Sir Charles beteg szíve felmondta a szolgálatot: alig ért az allé végébe, szörnyethalt…”
„Milyen egyszerű volt! A kutató valami sugárzó rádiumos vagy foszforos anyaggal rajzolta a térképet a karóra számlapjára. A számlap repedései között észrevétlenül bújtak meg azok a halvány, hajszálvékony vonalkák, amelyek úgyszólván láthatatlanok, csak éjjel világítanak, ha előzőleg napsütés érte a számlapot, és a foszforos anyag visszasugározta az elnyelt fényt. A kényes politikai ügyekben utazgató, térképező Russel első vázlatát erre a berepedt számlapra rajzolta fel, láthatatlan, illetve átlátszó anyaggal, amely elnyeli a sugarakat. Azután lefixírozta ragasztóval. Ha megtámadták, kikutatták, ezerszer is szétszedték az órát – nem találhattak semmit, mert a térkép csak akkor vált láthatóvá, ha erős napfény érte, és sötétben nézték.”
Az idézetekben szereplő kutya és óra között a legfontosabb kapocs: a titokzatos fényjelenség.
Foszforeszkált vagy fluoreszkált a számlap? Sokan nem tudják, hogy van-e különbség a két fogalom között; és ha van, akkor mi az?
Tanítványaink körében sem árt tisztázni a félreértéseket.
Ha egy test fluoreszkál, akkor a ráeső fényt (napfény, villanyfény stb.) jelentős mennyiségben másfajta, többnyire nagyobb hullámhosszú fénnyé alakítja. A fluoreszkáló molekulák ezáltal önálló fényforrássá válnak, világítani kezdenek.
A jelenség a fluoreszcein vagy rezorciftalein nevű piros kristályos vegyületről kapta a nevét. A vegyület híg oldatban sárga, tehát a fehér fényből a kék fényt abszorbeálja és kiegészítő színét, a sárgát sugározza ki. Az abszorbeált kék fény egy részét a fluoreszcein-molekulák (nagyobb hullámhosszú) zöld fénnyé alakítják, ezért a vegyület vizes oldata fény felé tartva sárgának tűnik, sötét háttér előtt mélyzöld.
A fluoreszkálás csak addig tart, amíg a fluoreszkáló testet a fény megvilágítja.

9. KÍSÉRLET
Szükséges anyagok: zöld levelek, desztillált víz, etil-alkohol.
Eszközök: főzőpohár, Bunsen-égő, vas háromláb, azbesztes drótháló.
Végrehajtás: A leveleket főzzük néhány percig desztillált vízben – a főzővíz halványzöld lesz. Öntsük le a vizet a levelekről, öntsünk kevés etil-alkoholt rájuk, hagyjuk állni kb. félóráig. (Gyorsabb a folyamat, ha meleg vízfürdőbe állítjuk a főzőpoharat.) Az alkoholos oldat zöld színű lesz, míg a levelek elhalványodnak. Ha az alkoholos klorofill-oldatot a napfény felé tartjuk, zöldnek látjuk, ha viszont ráeső fényben nézzük, akkor vörösnek tűnik.
Magyarázat: A klorofill fluoreszkál; a ráeső fény nagy részét más hullámhosszú fénnyé alakítja.
A fehér vagy sárga foszfor oxidációját vízgőz jelenlétében fénykibocsátás is kíséri: foszforeszkál. (A foszfor erről a jelenségről kapta a nevét, a „foszforosz” görög szó magyar jelentése: fényt hozó.) Vigyázat! A fehérfoszfor erősen mérgező és tűzveszélyes anyag.
A fehérfoszfor difoszfor-trioxiddá való oxidációja közben világít, villog. Ez a folyamat, a $\mathrm{P_{4}}$ oxidációja során kibocsátott sárgászöld fény a legkorábbi, amit a kemilumineszcencia jelenségére példaként följegyeztek, bár a reakciómechanizmus egyes részleteit még ma sem ismerjük teljesen. (A foszfor villogását gerjesztett foszfor-oxigén komplexmolekulák – $\mathrm{(PO)_{2}HPO,\ PO}$ – keletkezésével értelmezik, amelyek felesleges energiájukat sárgászöld fényt eredményező fotonok formájában sugározzák ki.)
A fluoreszcenciánál leírt kísérletet 11. osztályban, a foszfor tulajdonságainak ismertetésénél mutathatjuk be – igaz, nem kapcsolódik szorosan a témakörhöz; de a fluoreszcencia és a foszforeszkálás közötti különbséget talán így tehetjük látványosabbá és emlékezetesebbé. (Nekünk, tanároknak is tanulságos lenne, ha a kísérlet elvégzését házi feladatként adnánk fel: ki milyen színűnek látja az oldatot ráeső és áthaladó fényben. Biztosan lennének eltérő válaszok…)
4. Utószó
Szakdolgozatom célja az volt, hogy olyan lehetőségeket, módszereket, olyan tanári „fogásokat” találjak, amelyekkel a kémiát, ezt a kissé száraznak, unalmasnak látszó tantárgyat érdekessé, életszerűbbé lehet varázsolni.
Nem könnyű a kémiatanár feladata. A Nemzeti Alaptanterv a kémiát már nem mint önálló tantárgyat tekinti, hanem mint egy műveltségi terület részét; így a kémiaoktatásra szánt idő kevesebb lett, ezzel szemben a helyi tantervekben megfogalmazott elvárások egyre nőttek.
Hogyan lehet ebben a labilisnak tűnő helyzetben jó munkát végezni?
Először is keresni kell az élet és a mindennapok különböző területeihez kapcsolódó kémiai vonatkozásokat: egy újságcikkben, egy könyvben vagy akár a fürdőszobában. Ha találtunk valamit, kritikus szemmel meg kell vizsgálni, hogy mi az, ami tényleg felhasználható belőle a kémiaórák keretein belül.
Másodszor, ha az ismeretek adottak, ezeket valamilyen módon át kell adni a tanulóknak. Lehet történeteket mesélni, regényrészleteket felolvasni, látványos kísérleteket elvégezni vagy szorgalmi feladatokat adni. A legfontosabb mégis az, hogy izgalmasabb és hatékonyabb az oktatás, ha a gyerekek maguk mennek az ismeretek után; ha a tanár nem csupán átadja a saját tudását, hanem új ismeretekhez is jut. Hagyjuk érvényesülni, önállóan dolgozni a diákokat!
Három, látszólag teljesen különböző fogalomkört kapcsoltam össze: a misztikát, az irodalmat és a kémiát. Első ránézésre semmilyen összefüggés nincs közöttük, ám ha jobban megvizsgáljuk, rengeteg szál köti őket össze: gondoljunk csak az égő csipkebokorra, a nápolyi csodára, Aladdin csodalámpájára vagy Agatha Christie mérgeire. Megtalálni mindegyikben a közös vonásokat, összekapcsolni őket; felolvasni, elmesélni a történeteket, megvalósítani a jelenségeket, kísérletezni: ez a kémiatanár feladata.